Vestibular
- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Indicadores ácido-base
Uso de papel de tornassol como indicador ácido-base Desde a Antiguidade já existia a necessidade de se identificar se os compostos eram ácidos ou básicos. Além disso, as soluções ácidas apresentam diferentes níveis de acidez, assim como as...
- Simulado De Química
1-) NH 3 , H 2 O e CH 4 são, respectivamente, moléculas: a) polar, polar, apolar b) polar, polar, polar c) apolar, apolar, polar d) polar, apolar, apolar e) apolar, apolar, apolar 2-) (MED ? SANTOS) Nas dispersões coloidais, o diâmetro das partículas...
- Misturas E Substâncias Resumo
Mistura e substâncias puras Um conjunto de átomos com as mesmas propriedades químicas constitui um elemento químico, as substâncias. Essas, por sua vez, se caracterizam por uma porção desses átomos. Substância pura é aquela formada exclusivamente...
- Sistema De Inequação Do 1º Grau Exercícios
Sistema de inequação do 1º grau Um sistema de inequação do 1º grau é formado por duas ou mais inequações, cada uma delas tem apenas uma variável sendo que essa deve ser a mesma em todas as outras inequações envolvidas. Quando terminamos a...
Vestibular
Soluções e Coeficiente de Solubilidade - teoria e questões
Definição e classificação das soluções
Soluções são misturas de duas ou mais substâncias, elas podem ser classificadas adotando os seguintes critérios: Estado de agregação, Razão soluto/solvente e Natureza das partículas dispersas.
Estado de agregação: quanto a este aspecto, as soluções podem ser sólidas, líquidas ou gasosas.
Solução Sólida: os componentes desse tipo de solução se encontram no estado sólido (à temperatura ambiente).
Solução Líquida: os componentes dessa solução se encontram no estado líquido.
Solução Gasosa: todos os componentes dessa solução se encontram no estado gasoso.
Razão soluto/solvente: esta propriedade relaciona a quantidade de soluto em relação à quantidade de solvente, e classifica as soluções em diluídas, concentradas, saturadas e supersaturadas.
Solução diluída: a quantidade de soluto é muito pequena em relação à de solvente, sendo assim, a solução se encontra completamente diluída.
Solução concentrada: quando a quantidade de soluto é grande em relação à de solvente, ou seja, a solução não se encontra dissolvida.
Solução saturada: neste caso, a quantidade de soluto é a máxima permitida para uma certa quantidade de solvente, em determinada temperatura.
Solução supersaturada: este é um sistema instável, pois a quantidade de soluto é maior que a máxima permitida.
Natureza das partículas dispersas: as soluções podem se classificar em moleculares e iônicas em função da natureza das partículas dispersas.
Solução molecular: as partículas dispersas neste caso são moléculas.
Solução iônica: as partículas dispersas se encontram na forma de íons. Estas soluções também são chamadas de soluções eletrolíticas, porque possuem a capacidade de conduzir corrente elétrica.
Exemplo:
Solução aquosa de cloreto de sódio (NaCl). Observe os íons formados na reação:
NaCl ? Na+ + Cl -
Estado de agregação: quanto a este aspecto, as soluções podem ser sólidas, líquidas ou gasosas.
Solução Sólida: os componentes desse tipo de solução se encontram no estado sólido (à temperatura ambiente).
Solução Líquida: os componentes dessa solução se encontram no estado líquido.
Solução Gasosa: todos os componentes dessa solução se encontram no estado gasoso.
Razão soluto/solvente: esta propriedade relaciona a quantidade de soluto em relação à quantidade de solvente, e classifica as soluções em diluídas, concentradas, saturadas e supersaturadas.
Solução diluída: a quantidade de soluto é muito pequena em relação à de solvente, sendo assim, a solução se encontra completamente diluída.
Solução concentrada: quando a quantidade de soluto é grande em relação à de solvente, ou seja, a solução não se encontra dissolvida.
Solução saturada: neste caso, a quantidade de soluto é a máxima permitida para uma certa quantidade de solvente, em determinada temperatura.
Solução supersaturada: este é um sistema instável, pois a quantidade de soluto é maior que a máxima permitida.
Natureza das partículas dispersas: as soluções podem se classificar em moleculares e iônicas em função da natureza das partículas dispersas.
Solução molecular: as partículas dispersas neste caso são moléculas.
Solução iônica: as partículas dispersas se encontram na forma de íons. Estas soluções também são chamadas de soluções eletrolíticas, porque possuem a capacidade de conduzir corrente elétrica.
Exemplo:
Solução aquosa de cloreto de sódio (NaCl). Observe os íons formados na reação:
NaCl ? Na+ + Cl -
Diluição de uma solução
As soluções são misturas homogêneas formadas pelo soluto (aquele que é dissolvido) e o solvente (aquele que dissolve). Diluir uma solução consiste em adicionar a ela uma porção de solvente puro. Atividades comuns do dia a dia, como acrescentar água a um suco de fruta, misturar o detergente na água durante a lavagem de roupas, adicionar água a um medicamento ou aplicar solventes próprios às tintas para deixá-las mais fluidas são bons exemplos de diluição. O procedimento inverso à diluição é a concentração de soluções.
Questões de vestibular sobre soluções e Coeficiente de Solubilidade
Gabarito:
2) A 3) 200 g de água 4) 912,28 g de água 5) 48 g de sal 6) Se a 30º C tem capacidade de dissolver 60g de um dado sal, caso diminuamos a temperatura para 20º, o coeficiente de solubilidade passará a ser 30g/100 g de água. O máximo que poderá se cristalizar é portanto 30 g desse sal, ficando também no máximo 30 g em solução.
7) 01 - VERDADE, soluções são sempre misturas homogêneas
02 - FALSO, não necessariamente, só será heterogênea e saturada se apresentar corpo de fundo, e isso pode não acontecer.
04 - FALSO, quanto maior a quantidade de soluto/ g de água em que é dissolvido, maior a solubilidade da substância.
08 - FALSO, leia a resposta desse homem, é simplesmente completa http://br.answers.yahoo.com/question/index?qid=20111217083134AALNTHv
16 - FALSO, o que for colocado no recipiente, será retirado, não surgirá uma nova substância ao simplesmente separá-los.
32 - VERDADE, ao adicionarmos 145 g a 20º C, teremos uma solução saturada com corpo de fundo (bifásico), mas ao aquecermos a 50º C teremos uma solução saturada, que é monofásico.
SOMA = 37
Ao diluir uma solução, a massa (m1) do soluto não se altera, sendo a mesma na solução inicial e na final. O volume da solução aumentará (de V para V?), uma vez que será adicionada uma porção de solvente. A concentração, por sua vez, diminuirá (diluição e concentração são processos opostos). Logo, pode-se concluir que volume e concentração são grandezas inversamente proporcionais, ou seja, o primeiro aumenta à mesma proporção que o outro diminui.
Para calcular, utilizamos:
Para calcular, utilizamos:
- para a concentração inicial: C = m1 / V
- para a concentração final: C? = m1 / V?
Dado que a que a massa do soluto (m1) continua constante, chega-se à fórmula:
CV = C?V?
Observe o exemplo:
1) Ao diluir 100 mL de uma solução de cloreto de sódio, cuja concentração é igual a 15 g/L ao volume final de 150 mL, qual será a concentração final da solução?
Aplicando a fórmula de diluição CV = C?V?, temos:
100 . 15 = 150 . C?
C? = 10 g/L
C? = 10 g/L
Esta questão pode, ainda, serEser resolvida de uma segunda maneira, para a qual se utiliza a definição de concentração comum. Assim, temos:
? Solução inicial:
1000 mL de solução ????? 15 g de NaCl
100 mL de solução ????? x
x = 1,5 g de NaCl
100 mL de solução ????? x
x = 1,5 g de NaCl
Essa massa de soluto obtida (1,5 g de NaCl) não se altera na solução final.
? Solução final:
150 mL de solução ????? 1,5 g de NaCl
1000 mL de solução ????? y
1000 mL de solução ????? y
y = 10 g/L
Soluções Gasosas
As soluções gasosas são aquelas em que o disperso em maior quantidade é um gás. Estudaremos neste tópico apenas as soluções gasosas em que todos os seus constituintes são gases; e chamaremos estas soluções de misturas de gases visto que quase sempre tais misturas constituem sistemas homogêneos ou unifásicos. Como exceção a esta regra temos misturas de gases situadas num campo de força gravitacional, particularmente quando a altura é grande o bastante para que não se possa desprezar este efeito; assim, a fração molar dos gases da atmosfera é função da altitude e, portanto, a atmosfera não constitui uma solução.
As propriedades de estado mais utilizadas para descrever as misturas de gases são em número de nC + 4 e estão representadas na tabela 3; nC é o número de componentes independentes e neste capítulo será sempre igual ao número de substâncias químicas nSQ.
As equações empíricas que correlacionam as propriedades de estado constituem as expressões matemáticas das leis gerais dos gases ou equações de estado do sistema considerado. Iniciaremos o estudo para situações em que o número de componentes é igual a um, generalizando-o a seguir para as misturas de gases propriamente ditas.
Soluções Liquidas
Soluções líquidas são aquelas em que o disperso presente em maior quantidade é um líquido. Os outros dispersos podem ser sólidos, gases, vapores ou mesmo outros líquidos. As quantidades relativas dos dispersos podem, em teoria, assumir proporções as mais diversas. Na prática isto nem sempre é possível, pois dependendo das substâncias consideradas, a miscibilidade em certas condições não é total. Conseqüentemente, uma ou mais substâncias em maior ou menor grau se separa da solução, constituindo outras fases.
Consideraremos inicialmente apenas soluções binárias, constituídas por duas substâncias totalmente miscíveis (miscíveis em todas as proporções) e das quais uma seja líquida. A partir desse estudo, e sempre que possível, estenderemos as considerações para soluções mais complexas.
Soluções coloidais
Quando adicionamos solutos em solventes damos origem a três tipos de sistemas: soluções, suspensões e coloides.
Em um sistema, quando as partículas são muito pequenas e não podem ser vistas a olho nu, dizemos que é uma Solução Coloidal ou coloide.
Definindo: Solução coloidal é uma solução onde as partículas dispersas têm um tamanho médio compreendido entre 1 e 100 nanômetros (nm), denominadas partículas coloidais.Os coloides podem ser micelares, moleculares ou iônicos.
Colóides micelares: as partículas dispersas são compostas por agregados de átomos.
Colóides moleculares: são formados por macromoléculas.
Colóides iônicos: sua composição é feita por íons.
As soluções coloidais podem ser classificadas de várias maneiras, dependendo do tipo de partícula coloidal e do meio que está dissolvida, também chamado de meio dispergente.
Aerossol: são coloides onde um sólido ou um líquido é disperso em um gás. Exemplo: fumaças e neblinas.
Sol: é um sólido disperso em um líquido. Exemplo: colas, gomas em geral, em medicamentos como o leite de magnésia. Soluções coloidais na forma de sol podem ser vistas até no organismo de seres vivos, na forma de células vegetais e animais, de sangue e muitos outros fluidos biológicos.
Observação: O nome coloide provém de uma goma arábica chamada cola.
Emulsão: consiste na dispersão de um líquido em outro líquido. Exemplo: o leite, a manteiga, maionese, creme chantily. A maionese é um sistema coloidal porque as gotinhas de óleo se encontram dispersas no vinagre com auxílio da gema de ovo.
Espuma: é formada por um gás disperso em meio sólido ou em meio líquido Exemplo: espuma de barbear.
Gel: formado por um líquido disperso em um sólido. Exemplo: geleias.
Em um sistema, quando as partículas são muito pequenas e não podem ser vistas a olho nu, dizemos que é uma Solução Coloidal ou coloide.
Definindo: Solução coloidal é uma solução onde as partículas dispersas têm um tamanho médio compreendido entre 1 e 100 nanômetros (nm), denominadas partículas coloidais.Os coloides podem ser micelares, moleculares ou iônicos.
Colóides micelares: as partículas dispersas são compostas por agregados de átomos.
Colóides moleculares: são formados por macromoléculas.
Colóides iônicos: sua composição é feita por íons.
As soluções coloidais podem ser classificadas de várias maneiras, dependendo do tipo de partícula coloidal e do meio que está dissolvida, também chamado de meio dispergente.
Aerossol: são coloides onde um sólido ou um líquido é disperso em um gás. Exemplo: fumaças e neblinas.
Sol: é um sólido disperso em um líquido. Exemplo: colas, gomas em geral, em medicamentos como o leite de magnésia. Soluções coloidais na forma de sol podem ser vistas até no organismo de seres vivos, na forma de células vegetais e animais, de sangue e muitos outros fluidos biológicos.
Observação: O nome coloide provém de uma goma arábica chamada cola.
Emulsão: consiste na dispersão de um líquido em outro líquido. Exemplo: o leite, a manteiga, maionese, creme chantily. A maionese é um sistema coloidal porque as gotinhas de óleo se encontram dispersas no vinagre com auxílio da gema de ovo.
Espuma: é formada por um gás disperso em meio sólido ou em meio líquido Exemplo: espuma de barbear.
Gel: formado por um líquido disperso em um sólido. Exemplo: geleias.
Dispersões
Dispersões: é uma mistura onde uma substância se distribui (dispersa) em toda superfície de uma outra substância.
Disperso: (fase dispersa) ou Soluto;
Disperso ou Soluto + Dispersante, dispergente ou Solvente = Dispersão ou Solução.
OBS: toda solução também é dispersão, mas nem toda dispersão é solução
Coeficiente de Solubilidade
O coeficiente de solubilidade é a quantidade de soluto suficiente para saturar, ou seja, dissolver totalmente, o solvente, numa determinada temperatura.
Em relação à solução, deve-se ter em mente que quanto maior a quantidade de soluto, mais concentrada será a solução. Além disso, cada substância é saturada numa determinada quantidade de solvente.
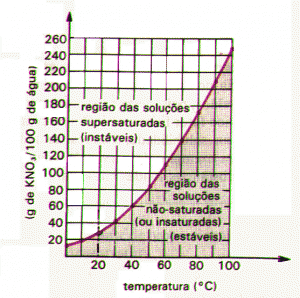
As soluções saturadas também podem ser com precipitado, quando sua quantidade de soluto é maior em relação a seu coeficiente de solubilidade, e supersaturadas, quando a quantidade de soluto é maior em relação ao coeficiente de solubilidade, porém, algum fator externo, como o aquecimento, pode dissolver o excesso. Uma determinada substância pode ter diferentes solubilidades em temperaturas diferentes.

O coeficiente de solubilidade é útil quando se analisa que haverá excesso de soluto quando suas moléculas não conseguirem mais realizar ligações, já que não haverá moléculas de solvente suficientes para a interação com as moléculas de soluto. Há, também, uma diferença de solubilidade do mesmo soluto em diferentes solventes.
A fórmula para o cálculo do coeficiente de solubilidade é: m1/Cs = m2/100
Exemplo: A 50 °C é possível dissolver no máximo 80g de Ba(NO3)2 em 100g de água. Logo, este é o coeficiente de solubilidade desse sal, nessa temperatura.
Cs=80g/100g de H2O.
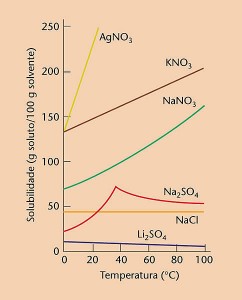
A maior parte das substâncias tem sua solubilidade aumentada com o aumento de temperatura. Os gases, porém, tem sua solubilidade diminuída.

Na figura acima, tem-se que a substância mais solúvel a 20º C é o AgNO3. a solubilidade do NaNO3 a 40ºC é 100g/100g de H2O.
Além disso, a solução do exercício abaixo demonstra o cálculo do coeficiente de solubilidade:
A solubilidade de um sal varia linearmente com a temperatura. A 30º C, 30g desse sal formam com água, 180g de uma solução saturada. Tal solução, quando aquecida a 70ºC, exige o acréscimo de mais 45g do sal para manter a saturação. Calcule o Cs do sal:
- a) a 30º C
- b) a 70º C
- c) a 50º C
Admita 100g como quantidade padrão de água.
Resolução:
a) 30ºC
Se há 30g de sal e 180g de solução, tem-se 150g de água.
150g de água?- 30g de sal
100g de agua ?- x
150x = 3000
x = 20g de sal
Cs do sal a 30ºC = 20g/100mL
b)
70ºC
30g + 45g = 75g de sal e 150g de água
150g de agua ?? 75g de sal
100g de agua ?? x
150x = 7500
x = 50g de sal
Cs do sal a 70ºC = 50g/100mL
c)
30ºC ?- 20g
50ºC ?? x
30x = 1000
x = 33,3g/100mL
Respostas:
a) Cs a 30ºC = 20g/100mL
b) Cs a 70ºC = 50g/100mL
c) Cs a 50ºC = 33,3g/100mL
Assim, tem-se acima o cálculo do coeficiente de solubilidade de um sal em três temperaturas diferentes. Nota-se que o resultado final também se altera.
1) Foram misturados e agitados 200g de sulfato de amônio com 250g de água, resultando num sistema heterogêneo que, por filtração, forneceu 5g de resíduo. Calcule o Cs do sal na temperatura em que a experiência foi realizada.
Solução:
Como foram utilizados 200g do sal para cada 250g de água e após filtração restou um massa de 5,0g do sal, então na realidade, conseguiu-se dissolver apenas 195du sal.
Podemos usar uma regra de tres simples e achar a massa do sal que foi dissolvida em 100g de água.
195g sal_____250g água
xg sal_______100g água
x= 78 g do sal para cada 100 g de água naquela temperatura. Esse é o chamado coeficiente de solubilidade da substância em questão, ou seja, a massa máxima que se consegue dissolver em 100g do solvente a uma dada temperatura.(Cs)
2) (FUVEST - SP) 160 gramas de uma solução aquosa saturada de sacarose a 30ºc são resfriados a 0º C. Quando o açúcar cristaliza?
Dados: 1- Temperatura 0º / Solubilidade da sacarose g/100 de H2O: 180. 2 - Temperatura 30º/ Solubilidade da sacarose g/100 de H20: 220.
a) 20g b) 40g c) 50g d) 64g e) 90g.
3) (UFMG) Sabendo que a solubilidade de um sal a 100°C é 39 g/100 g de H2O, calcule a massa de água necessária para dissolver 780 g deste sal a 100° C. Resposta: 2000g de água
4) (UFRJ) Sabendo que a solubilidade do brometo de potássio, KBr, a 60°C é 85,5 g/100 g de H2O, calcule a massa de água necessária para dissolver 780 g de KBr 60° C. Resposta: 912,28g de água
5) (PUC-MG) O coeficiente de solubilidade de um sal é de 60 g por 100 g de água a 80º C. Qual a massa desse sal, nessa temperatura, para saturar 80g de H2O.
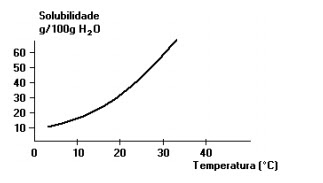
6) A curva de solubilidade de um dado sal é apresentada a seguir. Considerando a solubilidade desse sal a 30º C, qual seria a quantidade máxima (aproximada) de soluto cristalizada quando a temperatura da solução saturada (e em agitação) fosse diminuída para 20ºC?
7) A tabela a seguir fornece os valores de solubilidade do cloreto de sódio e do hidróxido de sódio, em água, a diferentes temperaturas.
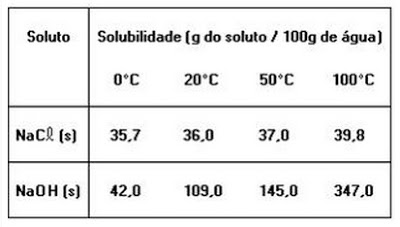
As informações anteriores e os conhecimentos sobre soluções permitem concluir:
01 - Soluções são misturar homogêneas
02 - Solução saturada é uma mistura heterogênea
04 - O hidróxido de sódio é mais solúvel em água do que o cloreto de sódio
08 - Soluções concentradas são soluções saturadas
16 - Quando se separa o soluto do solvente, obtêm-se substâncias diferentes daquelas que foram inicialmente misturadas.
3) (UFMG) Sabendo que a solubilidade de um sal a 100°C é 39 g/100 g de H2O, calcule a massa de água necessária para dissolver 780 g deste sal a 100° C. Resposta: 2000g de água
4) (UFRJ) Sabendo que a solubilidade do brometo de potássio, KBr, a 60°C é 85,5 g/100 g de H2O, calcule a massa de água necessária para dissolver 780 g de KBr 60° C. Resposta: 912,28g de água
5) (PUC-MG) O coeficiente de solubilidade de um sal é de 60 g por 100 g de água a 80º C. Qual a massa desse sal, nessa temperatura, para saturar 80g de H2O.
6) A curva de solubilidade de um dado sal é apresentada a seguir. Considerando a solubilidade desse sal a 30º C, qual seria a quantidade máxima (aproximada) de soluto cristalizada quando a temperatura da solução saturada (e em agitação) fosse diminuída para 20ºC?


As informações anteriores e os conhecimentos sobre soluções permitem concluir:
01 - Soluções são misturar homogêneas
02 - Solução saturada é uma mistura heterogênea
04 - O hidróxido de sódio é mais solúvel em água do que o cloreto de sódio
08 - Soluções concentradas são soluções saturadas
16 - Quando se separa o soluto do solvente, obtêm-se substâncias diferentes daquelas que foram inicialmente misturadas.
32 - Adicionando-se 145 g de hidróxido de sódio a 100 g de água, a 20º C, obtém-se um sistema bifásico, que, após aquecido a temperaturas acima de 50º C, apresenta-se monofásico.
Soma = ?
Gabarito:
2) A 3) 200 g de água 4) 912,28 g de água 5) 48 g de sal 6) Se a 30º C tem capacidade de dissolver 60g de um dado sal, caso diminuamos a temperatura para 20º, o coeficiente de solubilidade passará a ser 30g/100 g de água. O máximo que poderá se cristalizar é portanto 30 g desse sal, ficando também no máximo 30 g em solução.
7) 01 - VERDADE, soluções são sempre misturas homogêneas
02 - FALSO, não necessariamente, só será heterogênea e saturada se apresentar corpo de fundo, e isso pode não acontecer.
04 - FALSO, quanto maior a quantidade de soluto/ g de água em que é dissolvido, maior a solubilidade da substância.
08 - FALSO, leia a resposta desse homem, é simplesmente completa http://br.answers.yahoo.com/question/index?qid=20111217083134AALNTHv
16 - FALSO, o que for colocado no recipiente, será retirado, não surgirá uma nova substância ao simplesmente separá-los.
32 - VERDADE, ao adicionarmos 145 g a 20º C, teremos uma solução saturada com corpo de fundo (bifásico), mas ao aquecermos a 50º C teremos uma solução saturada, que é monofásico.
SOMA = 37
Fontes: http://www.infoescola.com/quimica/diluicao-de-solucoes/
http://www.mundoeducacao.com/quimica/classificacao-das-solucoes.htm
http://www.sempretops.com/estudo/coeficiente-de-solubilidade/
- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Indicadores ácido-base
Uso de papel de tornassol como indicador ácido-base Desde a Antiguidade já existia a necessidade de se identificar se os compostos eram ácidos ou básicos. Além disso, as soluções ácidas apresentam diferentes níveis de acidez, assim como as...
- Simulado De Química
1-) NH 3 , H 2 O e CH 4 são, respectivamente, moléculas: a) polar, polar, apolar b) polar, polar, polar c) apolar, apolar, polar d) polar, apolar, apolar e) apolar, apolar, apolar 2-) (MED ? SANTOS) Nas dispersões coloidais, o diâmetro das partículas...
- Misturas E Substâncias Resumo
Mistura e substâncias puras Um conjunto de átomos com as mesmas propriedades químicas constitui um elemento químico, as substâncias. Essas, por sua vez, se caracterizam por uma porção desses átomos. Substância pura é aquela formada exclusivamente...
- Sistema De Inequação Do 1º Grau Exercícios
Sistema de inequação do 1º grau Um sistema de inequação do 1º grau é formado por duas ou mais inequações, cada uma delas tem apenas uma variável sendo que essa deve ser a mesma em todas as outras inequações envolvidas. Quando terminamos a...
