Vestibular
Mistura e substâncias puras
Um conjunto de átomos com as mesmas propriedades químicas constitui um elemento químico, as substâncias. Essas, por sua vez, se caracterizam por uma porção desses átomos. Substância pura é aquela formada exclusivamente por partículas (moléculas ou átomos) quimicamente iguais.
As substâncias puras podem ser simples ou compostas como, por exemplo, o gás nitrogênio (N2), que é uma substância pura simples, pois é formado apenas pelo elemento N. Já a água é uma substância pura composta, pois contém dois elementos em suas moléculas (H2 + O).
Outros exemplos: o gás ozônio é formado por 3 átomos de oxigênio (O3), portanto é uma substância pura simples. Como também o gás hélio, cujas moléculas contêm um único átomo de He.
É muito difícil encontrar substâncias puras livres na natureza. Em geral, elas são produzidas em laboratório, por processos de fracionamento de misturas ou métodos de purificação.
Misturas são formadas por duas ou mais substâncias e se classificam em homogênea ou heterogênea, dependendo da natureza de seus constituintes, uma vez que toda mistura homogênea é uma solução.
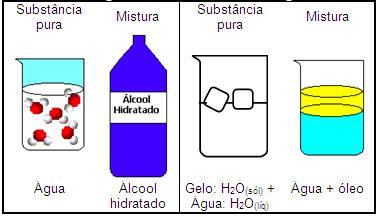
Tipos de misturas
Mistura homogênea ? é aquela que apresenta as mesmas propriedades em qualquer parte da sua extensão, apresenta apenas uma fase, é portanto, monofásica.
Exemplo: água + álcool; O ar que respiramos é uma mistura homogênea de vários componentes, entre eles nitrogênio e oxigênio
Mistura heterogênea ? é aquela que não apresenta as mesmas propriedades em todas as partes de sua extensão. Apresentam duas ou mais fases, podendo ser: bifásica, trifásica ou polifásica.
Exemplo: água + óleo, bifásica;

Água + Óleo
Processos de separação de misturas
Separação de misturas homogêneas
Evaporação: separa líquido do sólido. Quando exposta ao ar e sob temperatura ambiente, a parte líquida da mistura evapora-se, enquanto a parte sólida fica depositada.
Destilação: líquido do sólido.
A mistura é aquecida em um balão A até a ebulição, o componente líquido despende-se do sistema na forma de vapor, este passando pelas paredes frias do condensador volta ao estado líquido e vai gotejar em um balão B. Assim a parte sólida fica retida no balão A enquanto a líquida vai para o B.
Destilação fracionada: vários líquidos cujos pontos de ebulição sejam diferentes. O aparelho é o mesmo da destilação simples, contendo apenas um termômetro a mais. A mistura é aquecida e os líquidos vão destilando na ordem crescente de seus pontos de ebulição.
Solidificação fracionada: baseia-se no ponto de solidificação das substâncias, quando as duas estão dissolvidas num mesmo líquido.
Fusão fracionada: usada para separar substâncias contidas numa mistura sólida, baseia-se no de que o ponto de fusão é uma temperatura característica de cada sólido.
Sublimação: aplica-se a substâncias que passam diretamente do estado sólido para o estado de vapor. Recolhe-se os seus vapores e depois os mesmos são sublimados, separando-se do restante da mistura.
Liquefação e vaporização fracionada: misturas constituídas por vários gases. Em aparelhagem especial a solução gasosa é continuamente resfriada e à medida que os pontos de liquefação dos componentes vão sendo atingidos os mesmos vão passando ao estado líquido. A seguir são submetidos à evaporação fracionada, separando-se dessa maneira os vários gases.
Filtração: É utilizada para realizar a separação do líquido de uma mistura sólido-líquido ou sólido-gasoso. O ?equipamento? mais utilizado é o filtro de papel, usado para filtrar o café (um exemplo bastante prático do uso da filtração). Ele funciona como uma peneira microscópica, somente o líquido passa pelos seus minúsculos orifícios, acumulando a fase sólida dentro do filtro. 
Filtração do café


Num aspirador de pó, o filtro é utilizado para separar as partículas sólidas (poeira) do ar.
Separação de misturas heterogêneas
Catação: A catação é o tipo de separação de misturas do tipo ?sólido-sólido? , onde as substâncias são separadas manualmente, com uma pinça, colher, ou outro objeto auxiliador. É utilizada na separação de grãos bons e ruins de feijão, por exemplo, e também na separação dos diferentes tipos de materiais que compõem o lixo: vidro, metais, borracha, papel, plásticos, etc, para serem destinados à reciclagem.

Catação em um centro de reciclagem
Ventilação: separa os sólidos. Consiste na separação de uma das fases submetendo a mistura a uma corrente de ar; só pode se usada quando uma das fases é muito leve em relação a outra, ou seja possuem densidades diferentes.
Levigação: é um processo de separação de misturas heterogêneas de sólidos, com outras palavras, quando se tem dois sólidos de diferentes densidades onde se quer separar um do outro utilizasse a levigação.
Pega-se a mistura dos sólidos colocam-nos em um recipiente e utilizasse água corrente, onde o menos denso será carregado pela água corrente e o mais denso ficará retido no fundo do recipiente.
Este processo é utilizado nos garimpos onde o garimpeiro com uma peneira procura o ouro no fundo dos rios. O ouro fica misturado com a terra ou areia, e com a ajuda da água corrente, geralmente rios, a terra (menos denso) vai embora com a água e o ouro fica retido na peneira (mais denso).
A separação magnética é utilizada para separar misturas heterogêneas, onde um dos componentes da mistura é atraído por um ímã ou um eletroímã.
Flotação: substâncias sólidas de densidades diferentes. Coloca-se um líquido de densidade intermediária na mistura. Isso faz com que o líquido separe as substâncias: a de menor densidade fica na superfície do líquido e a de maior densidade abaixo.
Peneiração ou tamisação: pode ser usado quando as fases do sistema se reduzem a grãos de diferentes tamanhos quando o sistema é triturado; por meio de uma série de peneiras cujas malhas são gradativamente menores pode-se separar os componentes.
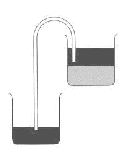
Sifonação: Um canudo é colocado de forma que fique uma ponta em um recipiente vazio, e a outra, no meio da substância mais leve no outro recipiente, como mostrado na figura abaixo:
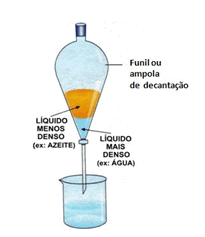
O funil de bromo é um recipiente de vidro em forma de balão, com uma abertura em cima e uma torneira em baixo. A mistura dos líquidos imiscíveis é colocada no balão, e um béquer fica em baixo da torneira. A torneira é aberta, e o líquido mais denso (que fica em baixo) vai escorrer para o béquer através da torneira.
Mistura e combinação
Se misturarmos duas substâncias, pode ou não ocorrer uma reação química. Se não ocorrer uma reação química, as substâncias misturadas podem ser separadas por um processo físico, como catação, filtração, separação magnética, dissolução, pois, como são as mesmas substâncias, elas mantém suas propriedades originais.
Se ocorrer uma reação química, formar-se-á uma (ou mais) nova substância e, conseqüentemente, as substâncias iniciais não poderão mais ser separadas por nenhum processo físico.
Com dois tipos de substâncias diferentes, podemos formar uma mistura ou combinação. Como? É fácil, seguindo o procedimento abaixo:
1. Misturar 2,5 g de ferro com 1,5 g de enxofre em um almofariz.
2. A amostra (4 g de ferro e enxofre) deve ser dividida em duas partes iguais.
3. Colocar uma das partes sobre um vidro de relógio e passar um ímã sobre a amostra a uma altura de 1 cm aproximadamente. Observe: A amostra é uma mistura pois, os componentes podem ser separados por processos físicos.
4. Adicionar 5 ml de ácido sulfúrico (solução a 10%) em um tubo de ensaio.
5. Juntar a outra parte da amostra (anteriormente dividida) e adicionar ao tubo de ensaio. Observe: A amostra reage com o meio liberando gases e formando uma combinação, visto que as substâncias iniciais não podem ser separados por nenhum processo físico.
http://www.coladaweb.com/quimica/quimica-geral/misturas
Questões
1) O mercúrio, um metal líquido, é utilizado pelos garimpeiros para extrair ouro. Nesse caso, o mercúrio forma com o ouro, uma mistura líquida homogênea, que pode ser separada facilmente da areia e da água. Infelizmente, esse processo causa muitos danos ao meio ambiente. O uso do mercúrio contamina o solo, as águas, o ar atmosférico e os próprios garimpeiros.
A separação do ouro é feita sob aquecimento, isso só é possível porque:
a) o ouro é mais volátil que o mercúrio.
b) o ouro é mais denso que o mercúrio.
c) o ponto de ebulição do mercúrio é menor que o do ouro.
d) o mercúrio funde-se a uma temperatura menor que o ouro.
e) o ouro dissolve-se no mercúrio.
2) (UFES) Na perfuração de uma jazida petrolífera, a pressão dos gases faz com que o petróleo jorre para fora. Ao reduzir-se à pressão, o petróleo bruto para de jorrar e tem de ser bombeado. Devido às impurezas que o petróleo bruto contém, ele é submetido a dois processos mecânicos de purificação antes do refino: separá-lo da água salgada e separá-lo de impurezas sólidas, como areia e argila. Esses processos mecânicos de purificação são, respectivamente:
a) decantação e filtração
b) decantação e destilação fracionada
c) filtração e destilação fracionada
d) filtração e decantação
e) destilação fracionada e decantação
3) É possível separar a mistura heterogênea SAL + AREIA? Qual e como seria o processo de separação?
4) Observe a imagem a seguir e responda as perguntas:

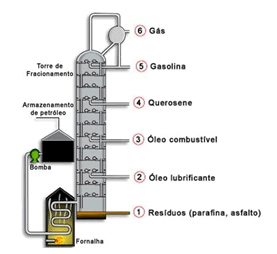
11) (FMU - SP) A água destilada é um exemplo de:
a) substância simples. b) composto químico
c) mistura homogênea. d) elemento químico.
e) mistura heterogênea.
12) Faça a correspondência:
(a) sistema polifásico e mistura heterogênea
(b) sistema polifásico e espécie química simples
(c) sistema polifásico e espécie química composta
(d) sistema monofásico e mistura homogênea
(e) sistema monofásico e espécie química simples
(f) sistema monofásico e espécie química composta
( ) ar atmosférico (isento de poeira)
( ) água do mar isenta de partículas em suspensão
( ) vinagre
( ) leite
( ) água
( ) álcool etílico
( ) qualquer solução
( ) enxofre durante a fusão
( ) enxofre
( ) gelo fundente
( ) água durante a ebulição
( ) gelo + água + vapor de água
( ) ferro
( ) granito
( ) quartzo
( ) pólvora
( ) água barrenta de um rio
( ) hidrogênio
( ) cloro
( ) cloro parcialmente liquefeito
13) Assinale (F) para as afirmações falsas e (V) para as afirmações verdadeiras:
( ) Toda mistura heterogênea é um sistema polifásico.
( ) Toda mistura homogênea é um sistema monofásico
( ) Todo sistema heterogêneo é um sistema polifásico
( ) Todo sistema homogêneo é sistema monofásico
( ) Todo sistema polifásico é sistema heterogêneo
( ) Todo sistema monofásico é sistema homogêneo
( ) Todo sistema polifásico é mistura heterogênea
( ) Todo sistema monofásico é mistura homogênea
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que todo sistema heterogêneo é uma mistura homogênea.
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que todo sistema homogêneo é uma mistura homogênea.
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que toda espécie química (simples ou composta) é um sistema homogêneo.
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que toda solução é um sistema homogêneo.
( ) Não existe sistema polifásico formado de vários gases ou vapores.
( ) Não existe sistema monofásico formado de vários sólidos (soluções sólidas).
( ) n sólidos na maioria dos casos constituem sistemas de n fases.
( ) A água é uma mistura de hidrogênio e oxigênio
( ) O cloreto de sódio é uma mistura de sódio e cloro.
( ) A pólvora é uma mistura de salitre, carvão e enxofre.
( ) A análise de certa amostra de salmoura mostrou que ela contém 10% de sal (cloreto de sódio) e 90% de água. É possível obter uma salmoura contendo 5% de sal e 95% de água.
( ) A análise de certa amostra de água mostrou que ela contém 11,1% de hidrogênio e 88,9% de oxigênio. É possível obter água contendo 5% de hidrogênio e 95% de oxigênio.
14) Faça a associação:
(1) ventilação
(2) flotação
(3) dissolução fracionada
(4) fusão fracionada
(5) catação
(6) levigação
(7) peneiração ou tamisação
(8) cristalização fracionada
(9) separação magnética
( ) Os componentes têm diferentes pontos de fusão
( ) Só uma das fases se dissolve no líquido usado
( ) Os fragmentos das diferentes fases, são relativamente grandes e visualmente diferentes entre si
( ) Uma das fases é arrastada por uma corrente de ar, separando-se, assim, das outras
( ) Só uma das fases é atraída pelo ímã
( ) Todas os sólidos são solúveis no líquido usado
( ) As fases estão reduzidas a grãos de diferentes tamanhos
( ) Uma das fases é arrastada por uma corrente de água separando-se, assim, das outras
( ) Usa-se um líquido de densidade intermediária em relação às densidades das fases e no qual as fases não se dissolvem
15) Estabelecer a correspondência entre as misturas e os processos utilizados na sua separação:
(a) água e óleo
(b) ar e poeira
(c) água e sal de cozinha
(d) limalha de ferro e enxofre
(e) sulfeto de zinco + ganga
(f) água e pó de giz
(g) nitrogênio e oxigênio
(h) petróleo
( ) liquefação fracionada
( ) separação magnética
( ) destilação fracionada
( ) decantação
( ) destilação simples
( ) filtração
( ) flotação
( ) centrifugação
16) (OSEC) Indicar a alternativa falsa:
a) Um sistema contendo apenas água e um pouco de açúcar forma uma mistura homogênea.
b) Um sistema constituído por três pedaços de ouro puro é monofásico.
c) Uma substância pura sempre constituirá um sistema monofásico.
d) A água e o álcool etílico formam misturas homogêneas em quaisquer proporções.
e) A água do filtro é uma mistura homogênea.
17) (UF-ES) Quantas fases estão presentes no sistema areia + sal + açúcar + água + gasolina ?
a) 1 b) 2 c) 3 d) 4 e) 5
18) (UF-SC)
I) Uma mistura homogênea de duas ou mais substâncias recebe o nome de ................;
II) Ao componente de menor quantidade dá-se o nome de .............;
III) Ao componente de maior quantidade dá-se o nome de ..............
As palavras que completam corretamente estas frases são, respectivamente:
a) solução, solvente, soluto
b) soluto, solução, solvente
c) solução, soluto, solvente
d) solvente, solução, soluto
e) solvente, soluto, solução.
19) (UF-RS) São dadas as seguintes características de um sistema:
I) É formado por um só tipo de átomos.
II) Apresenta pontos de fusão e de ebulição constantes;
III) É unifásico, incolor e inodoro;
IV) Resiste a processos comuns de fracionamento.
São critérios que definem uma substância pura:
a) I e II b) II e IV c) I, II e IV d) II, III e IV e) I e IV.
20) (UF-PA) O sistema constituído por água líquida, ferro sólido, gelo e vapor d?água apresenta:
a) 3 fases e 3 componentes
b) 3 fases e 2 componentes
c) 4 fases e 2 componentes
d) 4 componentes e 6 fases
e) 2 fases e 2 componentes.
21) (ESC. TÉC.-RJ) O petróleo é uma:
a) substância simples
b) substância composta
c) mistura homogênea
d) mistura heterogênea
e) variedade alotrópica do carbono.
22) Os sistemas seguintes devem ser classificados como:
1) sistema polifásico e mistura heterogênea
2) sistema polifásico e espécie química simples
3) sistema polifásico e espécie química composta
4) sistema monofásico e mistura homogênea
5) sistema monofásico e espécie química simples
6) sistema monofásico e espécie química composta
( ) gelo fundente
( ) álcool a 96º GL
( ) ar atmosférico (isento de poeira)
( ) ferro durante a fusão
( ) granito
( ) oxigênio parcialmente liqüefeito
( ) propano
( ) ozônio
A ordem das lacunas, de cima para baixo, é:
a) 3 - 4 - 6 - 2 - 1 - 2 - 6 - 5
b) 3 - 4 - 4 - 2 - 1 - 2 - 6 - 5
c) 1 - 4 - 4 - 1 - 1 - 2 - 6 - 5
d) 3 - 4 - 4 - 1 - 2 - 6 - 5 - 5
e) 4 - 3 - 2 - 6 - 1 - 5 - 2 - 5
23) (PUC-MG) São elementos que apresentam formas alotrópicas:
a) hidrogênio e oxigênio
b) fósforo e enxofre
c) carbono e nitrogênio
d) cálcio e silício
Gabarito:
1) D 2) A 3) As etapas utilizadas para separar a mistura Sal + Areia seriam as seguintes:
Dissolução: Adicione água à mistura até que o sal esteja totalmente diluído.
Filtração: Em seguida, promova a filtragem da solução através de papel filtro. A areia vai ficar retida no papel e a solução salina irá passar através dele. Para obter o sal puro basta aquecer o líquido até sua completa evaporação, o sal ficará no fundo do recipiente.
4) 1.Atração magnética
2.. Mistura heterogênea
3. A limalha de ferro é atraída pelo imã e então isolada.
5) 1.Decantação
2.Mistura heterogênea
3.Azeite puro
6) 1.Destilação fracionada
2.Mistura homogênea
3.Gás, gasolina, querosene, entre outros.
7) C 8) B 9) B 10) D 11) B 12) d, d, d, a, f, f, d, b, e, c, c, c, e, a, f, a, a, e, e, b
13) V, V, V, V, V, V, V, F, F, V, F, V, V, V, F, V, F, F, V, V, F
14) 4, 3, 5, 1, 9, 8, 7, 6, 2 15) g, d, h, a, c, b, e,f 16) C 17) C 18) C 19) B 20) C 21) D
22) B 23) B

- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Exercícios De Termologia
1. Em uma escala termométrica arbitrária A, atribui-se 0°A temperatura de fusão do gelo e 120°A à temperatura de ebulição da água. Quando a temperatura for de 20°C, na escala A, ler-se-à: a) 10°A b) 20°A c) 24°A d) 48°A e) 60°A 2....
- Questões Resolvidas De Vestibulares Sobre Hidrostática
Questões resolvidas de vestibular sobre Hidrostática - massa específica, densidade, pressão, pressão atmosférica e empuxo 1) (FCC 2005) Para responder as questões de números I e II considere uma piscina com as seguintes dimensões: comprimento:...
- Interações Intermoleculares Resumo (com Questões)
INTERAÇÕES INTERMOLECULARES As moléculas se atraem. Deste fato simples, surgem importantes conseqüências. Rios, lagos e oceanos existem porque as moléculas se atraem e formam um líquido. Sem esse líquido não haveria vida. Sem as forças entre...
- Propriedades E Estados Físicos Da Matéria
Propriedades Gerais da matéria A matéria tem 8 propriedades gerais, isto é, 8 características comuns a toda e qualquer porção de matéria: inércia, massa, extensão, impenetrabilidade, compressibilidade, elasticidade, divisibilidade e descontinuidade....
Vestibular
Misturas e substâncias resumo
Mistura e substâncias puras
Um conjunto de átomos com as mesmas propriedades químicas constitui um elemento químico, as substâncias. Essas, por sua vez, se caracterizam por uma porção desses átomos. Substância pura é aquela formada exclusivamente por partículas (moléculas ou átomos) quimicamente iguais.
As substâncias puras podem ser simples ou compostas como, por exemplo, o gás nitrogênio (N2), que é uma substância pura simples, pois é formado apenas pelo elemento N. Já a água é uma substância pura composta, pois contém dois elementos em suas moléculas (H2 + O).
Outros exemplos: o gás ozônio é formado por 3 átomos de oxigênio (O3), portanto é uma substância pura simples. Como também o gás hélio, cujas moléculas contêm um único átomo de He.
É muito difícil encontrar substâncias puras livres na natureza. Em geral, elas são produzidas em laboratório, por processos de fracionamento de misturas ou métodos de purificação.
Alotropia é o fenômeno em que um mesmo elemento químico (átomos de mesmo Z) forma duas ou mais substâncias simples diferentes.
| Elemento | Variedades alotrópicas | |
|---|---|---|
| Carbono (C) | Diamante (Cn) | Grafite (Cn) |
| Oxigênio (O) | Oxigênio (O2) | Ozônio (O3) |
| Fósforo (P) | Fósforo branco (P4) | Fósforo vermelho (Pn) |
| Enxofre (S) | Enxofre rômbico (S8) | Enxofre monoclínico (S8) |
| Grandeza molecular | Substância simples |
|---|---|
| moléculas monoatômicas | gases nobres |
| moléculas biatômicas | H2, N2, O2, F2, Cl2, Br2, I2 |
| moléculas triatômicas | O3 |
| moléculas tetratômicas | P4 |
| moléculas octatômicas | S8 |
| moléculas gigantes (macromoléculas) | Pn, Cn, todos os metais (Nan, Can, Agn) |
Misturas são formadas por duas ou mais substâncias e se classificam em homogênea ou heterogênea, dependendo da natureza de seus constituintes, uma vez que toda mistura homogênea é uma solução.
Tipos de misturas
Mistura homogênea ? é aquela que apresenta as mesmas propriedades em qualquer parte da sua extensão, apresenta apenas uma fase, é portanto, monofásica.
Exemplo: água + álcool; O ar que respiramos é uma mistura homogênea de vários componentes, entre eles nitrogênio e oxigênio
Mistura heterogênea ? é aquela que não apresenta as mesmas propriedades em todas as partes de sua extensão. Apresentam duas ou mais fases, podendo ser: bifásica, trifásica ou polifásica.
Exemplo: água + óleo, bifásica;

Água + Óleo
Processos de separação de misturas
Separação de misturas homogêneas
Evaporação: separa líquido do sólido. Quando exposta ao ar e sob temperatura ambiente, a parte líquida da mistura evapora-se, enquanto a parte sólida fica depositada.
Destilação: líquido do sólido.
A mistura é aquecida em um balão A até a ebulição, o componente líquido despende-se do sistema na forma de vapor, este passando pelas paredes frias do condensador volta ao estado líquido e vai gotejar em um balão B. Assim a parte sólida fica retida no balão A enquanto a líquida vai para o B.
Destilação fracionada: vários líquidos cujos pontos de ebulição sejam diferentes. O aparelho é o mesmo da destilação simples, contendo apenas um termômetro a mais. A mistura é aquecida e os líquidos vão destilando na ordem crescente de seus pontos de ebulição.
Solidificação fracionada: baseia-se no ponto de solidificação das substâncias, quando as duas estão dissolvidas num mesmo líquido.
Fusão fracionada: usada para separar substâncias contidas numa mistura sólida, baseia-se no de que o ponto de fusão é uma temperatura característica de cada sólido.
Sublimação: aplica-se a substâncias que passam diretamente do estado sólido para o estado de vapor. Recolhe-se os seus vapores e depois os mesmos são sublimados, separando-se do restante da mistura.
Liquefação e vaporização fracionada: misturas constituídas por vários gases. Em aparelhagem especial a solução gasosa é continuamente resfriada e à medida que os pontos de liquefação dos componentes vão sendo atingidos os mesmos vão passando ao estado líquido. A seguir são submetidos à evaporação fracionada, separando-se dessa maneira os vários gases.

Filtração do café
Tipos de filtros:


Separação de misturas heterogêneas
Catação: A catação é o tipo de separação de misturas do tipo ?sólido-sólido? , onde as substâncias são separadas manualmente, com uma pinça, colher, ou outro objeto auxiliador. É utilizada na separação de grãos bons e ruins de feijão, por exemplo, e também na separação dos diferentes tipos de materiais que compõem o lixo: vidro, metais, borracha, papel, plásticos, etc, para serem destinados à reciclagem.

Catação em um centro de reciclagem
Ventilação: separa os sólidos. Consiste na separação de uma das fases submetendo a mistura a uma corrente de ar; só pode se usada quando uma das fases é muito leve em relação a outra, ou seja possuem densidades diferentes.
Levigação: é um processo de separação de misturas heterogêneas de sólidos, com outras palavras, quando se tem dois sólidos de diferentes densidades onde se quer separar um do outro utilizasse a levigação.
Pega-se a mistura dos sólidos colocam-nos em um recipiente e utilizasse água corrente, onde o menos denso será carregado pela água corrente e o mais denso ficará retido no fundo do recipiente.
Este processo é utilizado nos garimpos onde o garimpeiro com uma peneira procura o ouro no fundo dos rios. O ouro fica misturado com a terra ou areia, e com a ajuda da água corrente, geralmente rios, a terra (menos denso) vai embora com a água e o ouro fica retido na peneira (mais denso).
A separação magnética é utilizada para separar misturas heterogêneas, onde um dos componentes da mistura é atraído por um ímã ou um eletroímã.
Flotação: substâncias sólidas de densidades diferentes. Coloca-se um líquido de densidade intermediária na mistura. Isso faz com que o líquido separe as substâncias: a de menor densidade fica na superfície do líquido e a de maior densidade abaixo.
Peneiração ou tamisação: pode ser usado quando as fases do sistema se reduzem a grãos de diferentes tamanhos quando o sistema é triturado; por meio de uma série de peneiras cujas malhas são gradativamente menores pode-se separar os componentes.
Decantação: É um processo de separação de misturas heterogêneas, principalmente de misturas compostas por líquidos (imiscíveis ou não (que não se misturam)). O recipiente contendo as substâncias é inclinado, derramando a substância mais leve (que fica em cima), em outro recipiente.
Um processo mais eficiente seria utilizando um sifão ou o funil de bromo.

Funil de bromo

Mistura e combinação
Se misturarmos duas substâncias, pode ou não ocorrer uma reação química. Se não ocorrer uma reação química, as substâncias misturadas podem ser separadas por um processo físico, como catação, filtração, separação magnética, dissolução, pois, como são as mesmas substâncias, elas mantém suas propriedades originais.
Se ocorrer uma reação química, formar-se-á uma (ou mais) nova substância e, conseqüentemente, as substâncias iniciais não poderão mais ser separadas por nenhum processo físico.
Com dois tipos de substâncias diferentes, podemos formar uma mistura ou combinação. Como? É fácil, seguindo o procedimento abaixo:
1. Misturar 2,5 g de ferro com 1,5 g de enxofre em um almofariz.
2. A amostra (4 g de ferro e enxofre) deve ser dividida em duas partes iguais.
3. Colocar uma das partes sobre um vidro de relógio e passar um ímã sobre a amostra a uma altura de 1 cm aproximadamente. Observe: A amostra é uma mistura pois, os componentes podem ser separados por processos físicos.
4. Adicionar 5 ml de ácido sulfúrico (solução a 10%) em um tubo de ensaio.
5. Juntar a outra parte da amostra (anteriormente dividida) e adicionar ao tubo de ensaio. Observe: A amostra reage com o meio liberando gases e formando uma combinação, visto que as substâncias iniciais não podem ser separados por nenhum processo físico.
http://www.coladaweb.com/quimica/quimica-geral/misturas
Questões
1) O mercúrio, um metal líquido, é utilizado pelos garimpeiros para extrair ouro. Nesse caso, o mercúrio forma com o ouro, uma mistura líquida homogênea, que pode ser separada facilmente da areia e da água. Infelizmente, esse processo causa muitos danos ao meio ambiente. O uso do mercúrio contamina o solo, as águas, o ar atmosférico e os próprios garimpeiros.
A separação do ouro é feita sob aquecimento, isso só é possível porque:
a) o ouro é mais volátil que o mercúrio.
b) o ouro é mais denso que o mercúrio.
c) o ponto de ebulição do mercúrio é menor que o do ouro.
d) o mercúrio funde-se a uma temperatura menor que o ouro.
e) o ouro dissolve-se no mercúrio.
2) (UFES) Na perfuração de uma jazida petrolífera, a pressão dos gases faz com que o petróleo jorre para fora. Ao reduzir-se à pressão, o petróleo bruto para de jorrar e tem de ser bombeado. Devido às impurezas que o petróleo bruto contém, ele é submetido a dois processos mecânicos de purificação antes do refino: separá-lo da água salgada e separá-lo de impurezas sólidas, como areia e argila. Esses processos mecânicos de purificação são, respectivamente:
a) decantação e filtração
b) decantação e destilação fracionada
c) filtração e destilação fracionada
d) filtração e decantação
e) destilação fracionada e decantação
3) É possível separar a mistura heterogênea SAL + AREIA? Qual e como seria o processo de separação?
4) Observe a imagem a seguir e responda as perguntas:

1. Qual o método de separação usado?
2. Qual a classificação para a mistura?
3. Quais os produtos obtidos ao final do processo?
2. Qual a classificação para a mistura?
3. Quais os produtos obtidos ao final do processo?
5) Observe a imagem a seguir e responda as perguntas:

1.Qual o método de separação usado?
2.Qual a classificação para a mistura?
3.Quais os produtos obtidos ao final do processo?
2.Qual a classificação para a mistura?
3.Quais os produtos obtidos ao final do processo?
6) Observe a imagem a seguir e responda as perguntas:
1. Qual o método de separação usado?
2. Qual a classificação para a mistura?
3. Quais os produtos obtidos ao final do processo?
2. Qual a classificação para a mistura?
3. Quais os produtos obtidos ao final do processo?

7) Não corresponde a um método de separação:
a) Flotação
b) Ventilação
c) Escoriação
d) Levigação
e) Peneiração
8) Assinale a alternativa que se refere ao processo de separação usada nas maquinas de beneficiamento de arroz:
a) Catação
b) Ventilação
c) Levigação
d) flotação
e) peneiração
9) É usado na destilação de petróleo para obter diversas frações e na purificação de solventes nas indústrias:
a) Liquefação
b) Destilação fracionada
c) Liquefação fracionada
d) Destilação
e) Centrifugação
10) (UFPI) Adicionando-se excesso de água à mistura formada por sal de cozinha, areia e açúcar, obtém-se um sistema:
a) homogêneo, monofásico;
b) homogêneo, bifásico;
c) heterogêneo, monofásico;
d) heterogêneo, bifásico;
e) heterogêneo, trifásico.
11) (FMU - SP) A água destilada é um exemplo de:
a) substância simples. b) composto químico
c) mistura homogênea. d) elemento químico.
e) mistura heterogênea.
12) Faça a correspondência:
(a) sistema polifásico e mistura heterogênea
(b) sistema polifásico e espécie química simples
(c) sistema polifásico e espécie química composta
(d) sistema monofásico e mistura homogênea
(e) sistema monofásico e espécie química simples
(f) sistema monofásico e espécie química composta
( ) ar atmosférico (isento de poeira)
( ) água do mar isenta de partículas em suspensão
( ) vinagre
( ) leite
( ) água
( ) álcool etílico
( ) qualquer solução
( ) enxofre durante a fusão
( ) enxofre
( ) gelo fundente
( ) água durante a ebulição
( ) gelo + água + vapor de água
( ) ferro
( ) granito
( ) quartzo
( ) pólvora
( ) água barrenta de um rio
( ) hidrogênio
( ) cloro
( ) cloro parcialmente liquefeito
13) Assinale (F) para as afirmações falsas e (V) para as afirmações verdadeiras:
( ) Toda mistura heterogênea é um sistema polifásico.
( ) Toda mistura homogênea é um sistema monofásico
( ) Todo sistema heterogêneo é um sistema polifásico
( ) Todo sistema homogêneo é sistema monofásico
( ) Todo sistema polifásico é sistema heterogêneo
( ) Todo sistema monofásico é sistema homogêneo
( ) Todo sistema polifásico é mistura heterogênea
( ) Todo sistema monofásico é mistura homogênea
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que todo sistema heterogêneo é uma mistura homogênea.
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que todo sistema homogêneo é uma mistura homogênea.
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que toda espécie química (simples ou composta) é um sistema homogêneo.
( ) Excluindo-se o caso de sistema em mudança de estado físico, podemos afirmar que toda solução é um sistema homogêneo.
( ) Não existe sistema polifásico formado de vários gases ou vapores.
( ) Não existe sistema monofásico formado de vários sólidos (soluções sólidas).
( ) n sólidos na maioria dos casos constituem sistemas de n fases.
( ) A água é uma mistura de hidrogênio e oxigênio
( ) O cloreto de sódio é uma mistura de sódio e cloro.
( ) A pólvora é uma mistura de salitre, carvão e enxofre.
( ) A análise de certa amostra de salmoura mostrou que ela contém 10% de sal (cloreto de sódio) e 90% de água. É possível obter uma salmoura contendo 5% de sal e 95% de água.
( ) A análise de certa amostra de água mostrou que ela contém 11,1% de hidrogênio e 88,9% de oxigênio. É possível obter água contendo 5% de hidrogênio e 95% de oxigênio.
14) Faça a associação:
(1) ventilação
(2) flotação
(3) dissolução fracionada
(4) fusão fracionada
(5) catação
(6) levigação
(7) peneiração ou tamisação
(8) cristalização fracionada
(9) separação magnética
( ) Os componentes têm diferentes pontos de fusão
( ) Só uma das fases se dissolve no líquido usado
( ) Os fragmentos das diferentes fases, são relativamente grandes e visualmente diferentes entre si
( ) Uma das fases é arrastada por uma corrente de ar, separando-se, assim, das outras
( ) Só uma das fases é atraída pelo ímã
( ) Todas os sólidos são solúveis no líquido usado
( ) As fases estão reduzidas a grãos de diferentes tamanhos
( ) Uma das fases é arrastada por uma corrente de água separando-se, assim, das outras
( ) Usa-se um líquido de densidade intermediária em relação às densidades das fases e no qual as fases não se dissolvem
15) Estabelecer a correspondência entre as misturas e os processos utilizados na sua separação:
(a) água e óleo
(b) ar e poeira
(c) água e sal de cozinha
(d) limalha de ferro e enxofre
(e) sulfeto de zinco + ganga
(f) água e pó de giz
(g) nitrogênio e oxigênio
(h) petróleo
( ) liquefação fracionada
( ) separação magnética
( ) destilação fracionada
( ) decantação
( ) destilação simples
( ) filtração
( ) flotação
( ) centrifugação
16) (OSEC) Indicar a alternativa falsa:
a) Um sistema contendo apenas água e um pouco de açúcar forma uma mistura homogênea.
b) Um sistema constituído por três pedaços de ouro puro é monofásico.
c) Uma substância pura sempre constituirá um sistema monofásico.
d) A água e o álcool etílico formam misturas homogêneas em quaisquer proporções.
e) A água do filtro é uma mistura homogênea.
17) (UF-ES) Quantas fases estão presentes no sistema areia + sal + açúcar + água + gasolina ?
a) 1 b) 2 c) 3 d) 4 e) 5
18) (UF-SC)
I) Uma mistura homogênea de duas ou mais substâncias recebe o nome de ................;
II) Ao componente de menor quantidade dá-se o nome de .............;
III) Ao componente de maior quantidade dá-se o nome de ..............
As palavras que completam corretamente estas frases são, respectivamente:
a) solução, solvente, soluto
b) soluto, solução, solvente
c) solução, soluto, solvente
d) solvente, solução, soluto
e) solvente, soluto, solução.
19) (UF-RS) São dadas as seguintes características de um sistema:
I) É formado por um só tipo de átomos.
II) Apresenta pontos de fusão e de ebulição constantes;
III) É unifásico, incolor e inodoro;
IV) Resiste a processos comuns de fracionamento.
São critérios que definem uma substância pura:
a) I e II b) II e IV c) I, II e IV d) II, III e IV e) I e IV.
20) (UF-PA) O sistema constituído por água líquida, ferro sólido, gelo e vapor d?água apresenta:
a) 3 fases e 3 componentes
b) 3 fases e 2 componentes
c) 4 fases e 2 componentes
d) 4 componentes e 6 fases
e) 2 fases e 2 componentes.
21) (ESC. TÉC.-RJ) O petróleo é uma:
a) substância simples
b) substância composta
c) mistura homogênea
d) mistura heterogênea
e) variedade alotrópica do carbono.
22) Os sistemas seguintes devem ser classificados como:
1) sistema polifásico e mistura heterogênea
2) sistema polifásico e espécie química simples
3) sistema polifásico e espécie química composta
4) sistema monofásico e mistura homogênea
5) sistema monofásico e espécie química simples
6) sistema monofásico e espécie química composta
( ) gelo fundente
( ) álcool a 96º GL
( ) ar atmosférico (isento de poeira)
( ) ferro durante a fusão
( ) granito
( ) oxigênio parcialmente liqüefeito
( ) propano
( ) ozônio
A ordem das lacunas, de cima para baixo, é:
a) 3 - 4 - 6 - 2 - 1 - 2 - 6 - 5
b) 3 - 4 - 4 - 2 - 1 - 2 - 6 - 5
c) 1 - 4 - 4 - 1 - 1 - 2 - 6 - 5
d) 3 - 4 - 4 - 1 - 2 - 6 - 5 - 5
e) 4 - 3 - 2 - 6 - 1 - 5 - 2 - 5
23) (PUC-MG) São elementos que apresentam formas alotrópicas:
a) hidrogênio e oxigênio
b) fósforo e enxofre
c) carbono e nitrogênio
d) cálcio e silício
Gabarito:
1) D 2) A 3) As etapas utilizadas para separar a mistura Sal + Areia seriam as seguintes:
Dissolução: Adicione água à mistura até que o sal esteja totalmente diluído.
Filtração: Em seguida, promova a filtragem da solução através de papel filtro. A areia vai ficar retida no papel e a solução salina irá passar através dele. Para obter o sal puro basta aquecer o líquido até sua completa evaporação, o sal ficará no fundo do recipiente.
4) 1.Atração magnética
2.. Mistura heterogênea
3. A limalha de ferro é atraída pelo imã e então isolada.
5) 1.Decantação
2.Mistura heterogênea
3.Azeite puro
6) 1.Destilação fracionada
2.Mistura homogênea
3.Gás, gasolina, querosene, entre outros.
7) C 8) B 9) B 10) D 11) B 12) d, d, d, a, f, f, d, b, e, c, c, c, e, a, f, a, a, e, e, b
13) V, V, V, V, V, V, V, F, F, V, F, V, V, V, F, V, F, F, V, V, F
14) 4, 3, 5, 1, 9, 8, 7, 6, 2 15) g, d, h, a, c, b, e,f 16) C 17) C 18) C 19) B 20) C 21) D
22) B 23) B

- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Exercícios De Termologia
1. Em uma escala termométrica arbitrária A, atribui-se 0°A temperatura de fusão do gelo e 120°A à temperatura de ebulição da água. Quando a temperatura for de 20°C, na escala A, ler-se-à: a) 10°A b) 20°A c) 24°A d) 48°A e) 60°A 2....
- Questões Resolvidas De Vestibulares Sobre Hidrostática
Questões resolvidas de vestibular sobre Hidrostática - massa específica, densidade, pressão, pressão atmosférica e empuxo 1) (FCC 2005) Para responder as questões de números I e II considere uma piscina com as seguintes dimensões: comprimento:...
- Interações Intermoleculares Resumo (com Questões)
INTERAÇÕES INTERMOLECULARES As moléculas se atraem. Deste fato simples, surgem importantes conseqüências. Rios, lagos e oceanos existem porque as moléculas se atraem e formam um líquido. Sem esse líquido não haveria vida. Sem as forças entre...
- Propriedades E Estados Físicos Da Matéria
Propriedades Gerais da matéria A matéria tem 8 propriedades gerais, isto é, 8 características comuns a toda e qualquer porção de matéria: inércia, massa, extensão, impenetrabilidade, compressibilidade, elasticidade, divisibilidade e descontinuidade....
