Vestibular
Reagentes ? Produtos
Através da Equação Química é possível saber o estado físico do átomo participante da reação, através das letras respectivas entre parênteses: Gás (g), Vapor (v), Líquido (l), Solução aquosa (aq), Sólido (s), Cristal (c).
Símbolos podem ser usados para descrever uma reação:
- Catalisadores ou aquecimento: ?
- Formação de um precipitado: ?
- Quando a reação é reversível: ?
- Presença de luz: ?
Números são utilizados para descrever as proporções das diferentes substâncias que entram nas reações, veja a equação:
H2 + Cl2 ? 2 HCl
Esse número que antecede o elemento, no caso o número 2, é chamado de coeficiente estequiométrico. A função desse coeficiente é indicar a quantidade de cada substância que participa da reação.
Balanceamento de equações químicas
1) Lei de conservação de massa: Essa lei indica que a soma das massas de todos os reagentes deve ser sempre igual à soma das massas de todos os produtos (princípio de Lavoisier).
2) Lei das proporções definidas: Os produtos de uma reação são dotados de uma relação proporcional de massa com os reagentes. Assim, se 12g de carbono reagem com 36g de oxigênio para formar 48g de dióxido de carbono, 6g de carbono reagem com 18g de oxigênio para formar 24g de dióxido de carbono.
3) Proporção atômica: De maneira análoga à lei das proporções definidas, os coeficientes estequiométricos devem satisfazer as atomicidades das moléculas de ambos os lados da equação. Portanto, são necessárias 3 moléculas de oxigênio (O2) para formar 2 moléculas de ozônio (O3).
Consiste em atribuir coeficientes algébricos à equação para serem futuramente determinados por meio da resolução de um sistema.
No composto CuSO4, o cobre possui Nox +2 e transforma-se em cobre puro com Nox 0. Assim como, o Níquel puro passa do estado 0 para o estado de oxidação +2. Portanto, o cobre 2+ sofre redução e o níquel oxidação.
Cu2+ + Ni ? Ni2+ + Cu, ou simplesmente, CuSO4 + Ni ? NiSO4 + Cu
Caso a quantidade de elétrons cedidos e ganhos não fosse igual, as duas semi-equações deveriam ser multiplicadas por números inteiros de modo a equilibrar as cargas.
2 KMnO4 + 16 HCl ? 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
2º) Ver se o número total de elétrons perdidos é igual ao número total de elétrons recebidos:
Fontes: http://www.infoescola.com
Solução:
Vamos usar melhor o raciocínio e ver que elementos estão presentes apenas em um composto:
Iodo de I, K e Mn potássio manganês. Deixe os seus índices e colocar os coeficientes apropriados.
(2-A) + HI (2b) KMnO4 + (c) ---- H2SO4 (a) I2 + (2b) MnSO4 + (b) + K2SO4 (d) H2O
Como podemos ver, estes três elementos já estão equilibradas. Agora vamos nos voltar para o outro:
2a + 2c = 2d, simplificando:
* A + c = d --- H
8b + 8b + 4c = 4b + d, simplificando:
* 4b + 4c = d ------- Ou
c = 2b + b, simplificando:
* C = 3b
Das três equações (4 incógnitas), testou-se b = 1:
b = 1
c = 3
d = 8
a = 5 Eis que os coeficientes da equação
A equação balanceada é:
10HI +3 +2 KMnO4 + H2SO4 ---- 2MnSO4 5I2 8 H2O + K2SO4
2) (UERJ) O bromato de potássio (KBrO3), adicionado à farinha de trigo com a finalidade de tornar o pão mais ?fofo?, ao ser aquecido transforma-se em brometo de potássio (KBr), produzindo gás oxigênio (O2).
Baseado nessas informações, responda:
I. Equacione e balanceie a reação com os menores coeficientes inteiros possíveis.
Os coeficientes X, Y, Z e W são, respectivamente:
a) 1 ; 1 ; 1 ; 2 ; 5 ; 1
b) 2 ; 10 ; 16 ; 2 ; 5 ; 8
c) 2 ; 10 ; 1 ; 2 ; 5 ; 1
d) 2 ; 10 ; 1 ; 2 ; 5; 8
e) 1 ; 4 ; 8 ; 1 ; 2 ; 4
x C3H5(NO3)3 (l) --> y CO2 (g) + z H2O (l) + w N2 (g) + k O2 (g)
A partir da equação, a soma dos coeficientes x + y + z + w + k é igual a:
Gabarito:
17) D 18) E 19) B 20) D 21) C 22) A 23) B 24) A 25) D
online
- Biografia, Vida E Realizações De Bhaskara
Bhaskara foi um matemático, professor, astrólogo e astrônomo indiano. É conhecido por ter criado a fórmula matemática aplicada na equação de 2° grau, embora haja controvérsias quanto a esse fato. Viveu de 1114 a 1185...
- Reações Químicas - Resumo (com Questões)
Reações químicas - conceito As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação...
- Número De Oxidação Resumo (com Questões)
Número de oxidaçãoNúmero de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon.O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência...
- Distância Entre Ponto E Reta Questões Vestibular
Artigo sobre distância entre ponto e reta com questões de vestibulares resolvidas. Distância entre ponto e reta Vamos realizar o estudo analítico da distância entre um ponto e uma reta no plano cartesiano. Considere um ponto P(xo, yo) e uma reta...
- Exercícios Resolvidos Equação Geral Da Circunferência
Artigo com exercícios resolvidos equação geral da circunferência 1) Dada a equação x2 + y2 + 2x + 8y + k = 0, obter k para que ela represente: a) uma circunferência; b) um único ponto; c) um conjunto vazio. Resolução 2) Qual das...
Vestibular
Métodos de balanceamento de equações químicas (com questões)
Equação química - conceito e representação
A equação química é a forma de se descrever uma reação química. Representam a escrita usada pelos químicos e de forma universal, ou seja, é a mesma em qualquer país.
A equação química é a forma de se descrever uma reação química. Representam a escrita usada pelos químicos e de forma universal, ou seja, é a mesma em qualquer país.
As substâncias que participam da reação química são chamadas de produtos ou reagentes na equação química.
Reagentes (1° membro) ? são as substâncias que estão no início da reação. São as que irão reagir, sofrer a transformação.
Produtos (2° membro) ? são as substâncias resultantes da reação química.
Representação de uma Equação Química:
Reagentes ? Produtos
Exemplo: Duas moléculas de gás hidrogênio juntam-se com uma molécula de gás oxigênio formando duas moléculas de água.
2H2 + O2 ? 2 H2O
reagente produto
reagente produto
Observe que o H2 e o O2 são reagentes e H2O é o produto.
Símbolos podem ser usados para descrever uma reação:
- Catalisadores ou aquecimento: ?
- Formação de um precipitado: ?
- Quando a reação é reversível: ?
- Presença de luz: ?
Números são utilizados para descrever as proporções das diferentes substâncias que entram nas reações, veja a equação:
H2 + Cl2 ? 2 HCl
Esse número que antecede o elemento, no caso o número 2, é chamado de coeficiente estequiométrico. A função desse coeficiente é indicar a quantidade de cada substância que participa da reação.
Através de uma equação é possível saber praticamente tudo sobre uma reação química.
Nas equações químicas, as substâncias podem aparecer com seus estados físicos:
(s) ? sólido
(l) ? líquido
(g) ? gasoso
(l) ? líquido
(g) ? gasoso
Exemplo:
C (s) + O2 (g) ? CO2 (g)
C (s) + O2 (g) ? CO2 (g)
A presença de átomos, íons ou moléculas em solução aquosa é representada pela abreviatura: (aq).
Balanceamento de equações químicas
Para que o balanceamento de equações químicas seja feito de maneira correta, deve-se atentar para os seguintes princípios:
1) Lei de conservação de massa: Essa lei indica que a soma das massas de todos os reagentes deve ser sempre igual à soma das massas de todos os produtos (princípio de Lavoisier).
2) Lei das proporções definidas: Os produtos de uma reação são dotados de uma relação proporcional de massa com os reagentes. Assim, se 12g de carbono reagem com 36g de oxigênio para formar 48g de dióxido de carbono, 6g de carbono reagem com 18g de oxigênio para formar 24g de dióxido de carbono.
3) Proporção atômica: De maneira análoga à lei das proporções definidas, os coeficientes estequiométricos devem satisfazer as atomicidades das moléculas de ambos os lados da equação. Portanto, são necessárias 3 moléculas de oxigênio (O2) para formar 2 moléculas de ozônio (O3).
Deve-se lembrar que, de acordo com a IUPAC, os coeficientes estequiométricos devem ser os menores valores inteiros possíveis.
Métodos de Balanceamento de equações químicasMétodo de balanceamento de equações químicas por Tentativas / Acerto de Coeficientes
Para fazer o acerto dos coeficientes das reações químicas, utilizamos o método das tentativas, que consiste apenas em contar o número de átomos dos reagentes e dos produtos.
Para facilitar, podemos começar acertando os metais. Em seguida os não-metais, depois oxigênio e por último o hidrogênio.
Nesta ordem:
1º) Metais
2º) Não-Metais
3º) Oxigênio
4º) Hidrogênio
Balanceamento pelo método algébrico
Consiste em atribuir coeficientes algébricos à equação para serem futuramente determinados por meio da resolução de um sistema.
É em geral bastante eficaz, mas pode vir a tornar-se bastante trabalhoso dependendo do número de espécies envolvidas na equação.
Exemplo: NH4NO3 ? N2O + H2O
Passo 1: Identificar os coeficientes.
aNH4NO3 ? bN2O + cH2O
Passo 2: Igualar as atomicidades de cada elemento respeitando a regra da proporção atômica. Assim, deve-se multiplicar a atomicidade de cada elemento da molécula pelo coeficiente estequiométrico identificado anteriormente.
Para o nitrogênio: 2a = 2b (pois existem 2 átomos de N na molécula NH4NO3)
Para o hidrogênio: 4a = 2c
Para o oxigênio: 3a = b + c
Ou seja, o número de átomos de cada elemento deve ser igual no lado dos reagentes e no lado dos produtos.
Passo 3: Resolver o sistema de equações:
Se 2a = 2b, tem-se que a = b.
Se 4a = 2c, tem-se que 2a = c.
Portanto, atribuindo-se o valor arbitrário 2 para o coeficiente a, tem-se:
a = 2, b = 2, c = 4.
Mas, como os coeficientes devem ser os menores valores inteiros possíveis:
a = 1, b = 1, c = 2.
Passo 4: Substituir os valores obtidos na equação original
1NH4NO3 ? 1N2O + 2H2O, ou simplesmente, NH4NO3 ? N2O + 2H2O
Balanceamento de equações químicas pelo método redox
Baseia-se nas variações dos números de oxidação dos átomos envolvidos de modo a igualar o número de elétrons cedidos com o número de elétrons ganhos. Se no final do balanceamento redox faltar compostos a serem balanceados, deve-se voltar para o método das tentativas e completar com os coeficientes restantes.
Exemplo: Fe3O4 + CO ? FeO + CO2
Passo 1: Identificar os átomos que sofrem oxirredução e calcular as variações dos respectivos números de oxidação.
Sabendo-se que o Nox do oxigênio é -2 para todos os compostos envolvidos. O Nox do Ferro varia de +8/3 para +2. E, o Nox do carbono de +2 para +4.
Portanto, o ferro se reduz e o carbono se oxida.
?Fe = 8/3 ? 2 = 2/3 (variação de Nox do ferro)
?C = 4 ? 2 = 2 (variação de Nox do carbono)
Passo 2: Multiplicar a variação de Nox pela respectiva atomicidade no lado dos reagentes e atribuir o valor obtido como o coeficiente estequiométrico da espécie que sofreu processo reverso. Assim, o número obtido pela multiplicação da variação de Nox do ferro pela sua atomicidade deve ser atribuído como o coeficiente estequiométrico da molécula de CO.
Para o ferro: 2/3 . 3 = 2
Para o carbono: 2 . 1 = 2
Portanto, o coeficiente do Fe3O4 é igual a 2, e o coeficiente do CO também.
2Fe3O4 + 2CO ? FeO + CO2
Simplificando-se os coeficientes para os menores valores inteiros possíveis, tem-se:
Fe3O4 + CO ? FeO + CO2
Passo 3: Acrescentar os coeficientes restantes
Para completar o balanceamento, pode-se realizar o mesmo procedimento utilizado no lado dos reagentes (multiplicando a variação de Nox pela atomicidade do elemento na molécula) ou realizar o método de tentativas.
A primeira opção é a mais viável, embora para equações mais simples (como a indicada como exemplo) possa ser utilizado o segundo método. O fato é que ambos os métodos devem levar à mesma resposta final.
Como a atomicidade do carbono no CO2 é igual a 1, multiplicando-se pela variação do Nox 2, obtém-se o coeficiente 2 para o FeO. Do mesmo modo, sendo a variação de Nox do ferro igual a 2/3, multiplicando-se pela atomicidade 1 na molécula de FeO, obtém-se o coeficiente 2/3 para o CO2.
Agora, basta balancear o lado dos produtos:
Fe3O4 + CO ? 2FeO + 2/3CO2
Como os coeficientes devem ser os menores valores inteiros possíveis, deve-se multiplicar a equação por 3/2 a fim de retirar o coeficiente fracionário do CO2:
Fe3O4 + CO ? 3FeO + CO2
Balanceamento pelo método íon-elétron
Baseia-se na divisão da reação global de oxirredução em duas semi-equações. Sendo que, para a semi-equação de redução deve-se acrescentar os elétrons no lado dos reagentes e o ânion no lado dos produtos. De forma análoga, para a semi-equação de oxidação, deve-se adicionar os elétrons no lado dos produtos junto à espécie oxidada, enquanto que no lado de reagentes deve estar a espécie mais reduzida.
Exemplo: CuSO4 + Ni ? NiSO4 + Cu
Passo 1: Identificar as espécies que sofrem oxidação e redução
No composto CuSO4, o cobre possui Nox +2 e transforma-se em cobre puro com Nox 0. Assim como, o Níquel puro passa do estado 0 para o estado de oxidação +2. Portanto, o cobre 2+ sofre redução e o níquel oxidação.
Passo 2: Escrever as semi-equações
Cu2+ + 2e ? Cu
Ni ? Ni2+ + 2e
Passo 3: Somar as semi-equações de modo a balanceá-las e cancelar os elétrons cedidos com os ganhos
Cu2+ + Ni ? Ni2+ + Cu, ou simplesmente, CuSO4 + Ni ? NiSO4 + Cu
Caso a quantidade de elétrons cedidos e ganhos não fosse igual, as duas semi-equações deveriam ser multiplicadas por números inteiros de modo a equilibrar as cargas.
Se a equação inicial possuir íons H+ em um dos lados ou átomos de oxigênio, também em um dos lados, deve-se balancear a primeira espécie com moléculas de hidrogênio e a segunda com moléculas de água.
Balanceamento por Oxirredução
Balancear uma reação de oxirredução é fazer com que o número total de e? cedidos pelo redutor seja igual ao número total de e? recebidos pelo oxidante.
Procedimento
*1º passo: Determinar os números de oxidação:
Esse passo é importante porque normalmente não conseguimos visualizar rapidamente quais são as espécies que sofrem oxidação e redução.
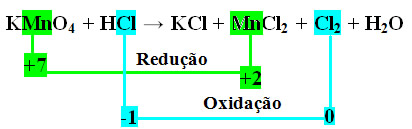
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
KMnO4 + HCl ? KCl + MnCl2 + Cl2 + H2O
KMnO4 + HCl ? KCl + MnCl2 + Cl2 + H2O
*2º passo: Determinação da variação da oxidação e da redução:

Observe que o manganês (Mn) sofre redução e o cloro (Cl) sofre oxidação.
MnCl2 = ?Nox = 5
Cl2 = ?Nox = 2
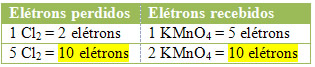
No caso do cloro, podemos notar que o HCl originou 3 compostos (KCl, MnCl2, e Cl2), mas o que nos interessa é o Cl2, pois é o seu Nox que sofreu variação. Cada cloro que forma Cl2 perde 1 elétron; como são necessários 2 cloros para formar cada Cl2, são perdidos então dois elétrons.
3º passo: Inversão dos valores de ?:
Nesse passo, os valores de ? são trocados entre as espécies citadas, tornando-se os coeficientes delas:
MnCl2 = ?Nox = 5 ? 5 será o coeficiente de Cl2
Cl2 = ?Nox = 2? 2 será o coeficiente de MnCl2
KMnO4 + HCl ? KCl + 2 MnCl2 + 5 Cl2 + H2O
Nesse momento já é possível conhecer dois coeficientes da equação.
Observação: normalmente, na maioria das reações, essa inversão de valores é efetuada no 1º membro. Mas, como regra geral, isso deve ser feito no membro que tiver maior número de átomos que sofrem oxirredução. Se esse critério não puder ser observado, invertemos os valores no membro que tiver maior número de espécies químicas. Foi isso o que foi realizado aqui, pois o 2º membro possui mais substâncias.
4º passo: Balanceamento por tentativa:
KMnO4 + HCl ? KCl + 2 MnCl2 + 5 Cl2 + H2O
- Visto que no segundo membro há dois átomos de manganês, conforme mostrado pelo coeficiente, no primeiro também deverá haver. Portanto, temos:
2 KMnO4 + HCl ? KCl + 2 MnCl2 + 5 Cl2 + H2O
- Com isso, a quantidade de potássio (K) no 1º membro ficou de 2, que será o mesmo coeficiente para esse átomo no segundo membro:
2 KMnO4 + HCl ? 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- A quantidade de cloros (Cl) no 2º membro é de 16 no total, por isso o coeficiente do HCl do 1º membro será:
2 KMnO4 + 16 HCl ? 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- O número de hidrogênios do 1º membro é 16, por isso o coeficiente da água (H2O) do 2º membro será igual a 8, pois a multiplicação do índice do hidrogênio (2) por 8 é igual a 16:
2 KMnO4 + 16 HCl ? 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Para conferir se a equação está corretamente balanceada podemos ver dois critérios:
1º) Verificar se a quantidade de cada átomo nos dois membros está igual:
2 KMnO4 + 16 HCl ? 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K =2 K =2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2º) Ver se o número total de elétrons perdidos é igual ao número total de elétrons recebidos:

Fontes: http://www.infoescola.com
http://www.brasilescola.com/
http://www.profpc.com.br/
Questões resolvidas sobre balanceamento de equações químicas
1) Faça o balanceamento da equação HI + KMnO4 + H2SO4 + ---- + K2SO4 + I2 MnSO4 H2O
Solução:
Vamos usar melhor o raciocínio e ver que elementos estão presentes apenas em um composto:
Iodo de I, K e Mn potássio manganês. Deixe os seus índices e colocar os coeficientes apropriados.
(2-A) + HI (2b) KMnO4 + (c) ---- H2SO4 (a) I2 + (2b) MnSO4 + (b) + K2SO4 (d) H2O
Como podemos ver, estes três elementos já estão equilibradas. Agora vamos nos voltar para o outro:
2a + 2c = 2d, simplificando:
* A + c = d --- H
8b + 8b + 4c = 4b + d, simplificando:
* 4b + 4c = d ------- Ou
c = 2b + b, simplificando:
* C = 3b
Das três equações (4 incógnitas), testou-se b = 1:
b = 1
c = 3
d = 8
a = 5 Eis que os coeficientes da equação
A equação balanceada é:
10HI +3 +2 KMnO4 + H2SO4 ---- 2MnSO4 5I2 8 H2O + K2SO4
2) (UERJ) O bromato de potássio (KBrO3), adicionado à farinha de trigo com a finalidade de tornar o pão mais ?fofo?, ao ser aquecido transforma-se em brometo de potássio (KBr), produzindo gás oxigênio (O2).

O crescimento do pão, ao ser assado, faz
com que surjam buracos em seu interior.
com que surjam buracos em seu interior.
Baseado nessas informações, responda:
I. Equacione e balanceie a reação com os menores coeficientes inteiros possíveis.
II. Classifique a reação.
III. O que provoca a ?fofura? do pão?
3) (PUC-RJ) O óxido de alumínio (Al2O3) é utilizado como antiácido. A reação que ocorre no estômago é:
X Al2O3 + Y HCl ? Z AlCl3 + W H2O
Os coeficientes X, Y, Z e W são, respectivamente:
a) 1, 2, 3, 6.
b) 1, 6, 2, 3.
c) 2, 3, 1, 6.
d) 2, 4, 4, 3.
e) 4, 2, 1, 6.
4) Efetue o balanceamento das equações a seguir:
a) Mg (s) + O2 (g) ? MgO (s)
b) CH4 (g) + O2 (g) ? CO2 (g) + H2O (l)
c) C2H4 + O2 ? CO2 + H2O
d) C2H6O + O2 ? CO2 + H2O
5) Observe esta reação iônica:
MnO4- + I- + H+ ? Mn2+ + I2 + H2O
Assinale a alternativa que corresponde aos coeficientes corretamente balanceados.
b) 2 ; 10 ; 16 ; 2 ; 5 ; 8
c) 2 ; 10 ; 1 ; 2 ; 5 ; 1
d) 2 ; 10 ; 1 ; 2 ; 5; 8
e) 1 ; 4 ; 8 ; 1 ; 2 ; 4
6) (OSEC/SP) A soma dos coeficientes da equação abaixo é igual a:
Br2 + KOH ? KBrO3 + KBr + H2O
a) 13
b) 20
c) 19
d) 15
e) 18
7) (UNIP/SP) A soma dos menores coeficientes inteiros que balanceiam a equação:
Cl2 + NH3 ? N2H4 + NH4Cl é:
a) 4
b) 15
c) 21
d) 8
e) 6
8) (PUCCAMP) Num ?sapato de cromo?, o couro é tratado com um banho de ?licor de cromo?, preparado através da reação representada pela equação:
Na2Cr2O7 + x SO2 + H2O ? y Cr(OH)SO4 + Na2SO4
Depois de balanceada com os menores coeficientes inteiros possíveis, ela apresenta:
x y
a) 3 2
b) 2 3
c) 2 2
d) 3 3
e) 2 1
9) (FUVEST) A decomposição térmica de 1 mol de dicromato de amônio é representada pela equação:
(NH4)2Cr2O7 ? N2 + CrxOy + z H2O
Os valores de x, y e z são, respectivamente:
a) 2, 3 e 4
b) 2, 7 e 4
c) 2, 7 e 8
d) 3, 2 e 4
e) 3, 2 e 8
10) A soma dos coeficientes inteiros que balanceiam a equação:
xA?(OH)3 + yH2S ? zA?2S3 + wH2O
a) 10 b) 11 c) 12 d) 13 e) 14
11) (UFC/2007) Alguns compostos químicos são tão instáveis que sua reação de decomposição é explosiva. Por exemplo, a nitroglicerina se decompõe segundo a equação química abaixo:
x C3H5(NO3)3 (l) --> y CO2 (g) + z H2O (l) + w N2 (g) + k O2 (g)
A partir da equação, a soma dos coeficientes x + y + z + w + k é igual a:
a) 11
b) 22
c) 33
d) 44
e) 55
b) 22
c) 33
d) 44
e) 55
12) (Mackenzie-SP) Das equações abaixo, estão balanceadas incorretamente:
16) Acerte por tentativa os coeficientes das equações abaixo, com os menores números inteiros:
a) N2 + H2 ? NH3
b) C + O2 ? CO
c) N2O5 + H2O ? HNO3
d) C3H8 + O2 ? CO2 + H2O
e) SO2 + O2 ? SO3
f) H2SO4 + NaOH ? Na2SO4 + H2O
17) (UFLAVRAS-MG) Considere a equação química não balanceada: SO2 + O2 ? SO3
Efetuando-se o balanceamento, a soma dos coeficientes é igual a:
a) 4
b) 3
c) 7
d) 5
e) zero
18) (MACKENZIE-SP) A equação INCORRETAMENTE balanceada é:
a) 2Hg2O ? 4Hg + O2
b) K2O2 + 2H2O ? 2KOH + H2O2
c) 2NH4NO3 ? 2N2 + O2 + 4H2O
d) CaCO3 + H2SO4 ? CaSO4 + CO2 + H2O
e) A? + 3HC? ? A?C?3 + 3H2
19) Uma das maneiras de impedir que o SO2, um dos responsáveis pela chuva ácida, seja liberado para
a atmosfera é tratá-lo previamente com óxido de magnésio em presença de ar. Analisando a equação
dada e, balanceando-a, o menor coeficiente inteiro do oxigênio é:
SO2 + MgO + O2 ? MgSO4
a) 1/2
b) 1
c) 1,5
d) 2
e) 2,5
20) (PUC-MG) A equação não balanceada que representa o ataque do ácido fluorídríco ao vidro,
deixando-o fosco, é a seguinte: HF + SiO2 ? H2SiF6 + H2O
A soma total dos coeficientes mínimos e inteiros das espécies químicas envolvidas, após o
balanceamento da equação, é:
a) 5
b) 7
c) 8
d) 10
e) 12
21) Assinale a alternativa correta com relação à equação abaixo:
2 KClO3 ==> 2 KCl + 3 O2
a) A equação não está balanceada
b) KCl e O2 são os reagentes desta reação
c) A equação está balanceada e KClO3 é o reagente desta reação.
d) KClO3 e O2 e são os produtos desta reação
22) Assinale a alternativa correta com relação à equação abaixo:
MnO2 + HCl ==> MnCl2 + Cl2
a) A equação não está balanceada
b) MnCl2 e HCl são os reagentes desta reação
c) A equação está balanceada.
d) MnO2 e Cl2 são os produtos desta reação.
23) Completando a reação H3PO4 + Ba(OH)2 ==> ............. + H2O e acertando os coeficientes, a alternativa que corresponde aos coeficientes estequiometricamente corretos é:
a) 2, 3, 3, 6.
b) 2, 3, 1, 6.
c) 1, 1, 3, 1.
d) 1, 3, 1, 1.
e) 1, 1, 1, 1.
24) A reação de neutralização total H3PO4 + Ba(OH)2 ==> Ba3(PO4)2 + H2O após ser balanceada apresentará os seguintes coeficientes estequiométricos, respectivamente:
a) 2, 3, 1, 6.
b) 1, 1, 3, 1.
c) 1, 3, 1, 1.
d) 2, 3, 3, 6.
e) 1, 1, 1, 1.
25) Dadas as equações químicas não balanceadas:
Al(OH)3 + H2SO4 ==> Al2(SO4)3 + H2O
C3H8 + O2 ==> CO2 + H2O
As somas dos coeficientes (menores e inteiros possíveis) de cada equação química são, respectivamente:
a) 10 e 11.
b) 10 e 10.
c) 12 e 12.
d) 12 e 13.
e) 15 e 14.
I. NH3 + HC? ? NH4C?
II. BaC?2 + H2SO4 ? HC? + BaSO4
III. C2H6O + O2 ? CO2 + H2O
IV. N2 + H2 ? NH3
a) Somente I e II.
b) Somente I e III.
c) Somente II e IV.
d) Somente II, III e IV.
e) Todas.
13) (Unifor-CE) O coeficiente do O2 na equação química:
2 Fe + ___ O2 ? Fe2O3 É corretamente indicado pelo número:
a) 1,0
b) 1,5
c) 3
d) 3,5
e) 5
14) (PUC-RJ) O óxido de alumínio (A?2O3) é utilizado como antiácido. A reação que ocorre no estômago é:
X A?2O3 + Y HC? ? Z A?C?3 + W H2O
Os coeficientes x, y, z e w são, respectivamente:
a) 1, 2, 3, 6
b) 1, 6, 2, 3
c) 2, 3, 1, 6
d) 2, 4, 4, 3
e) 4, 2, 1, 6
15) (UFMG-MG) A equação: Ca(OH)2 + H3PO4 ? Ca3(PO4)2 + H2O não está balanceada. Balanceando-a com os menores números possíveis, a soma dos coeficientes será:
a) 4
b) 7
c) 10
d) 11
e) 12
16) Acerte por tentativa os coeficientes das equações abaixo, com os menores números inteiros:
a) N2 + H2 ? NH3
b) C + O2 ? CO
c) N2O5 + H2O ? HNO3
d) C3H8 + O2 ? CO2 + H2O
e) SO2 + O2 ? SO3
f) H2SO4 + NaOH ? Na2SO4 + H2O
17) (UFLAVRAS-MG) Considere a equação química não balanceada: SO2 + O2 ? SO3
Efetuando-se o balanceamento, a soma dos coeficientes é igual a:
a) 4
b) 3
c) 7
d) 5
e) zero
18) (MACKENZIE-SP) A equação INCORRETAMENTE balanceada é:
a) 2Hg2O ? 4Hg + O2
b) K2O2 + 2H2O ? 2KOH + H2O2
c) 2NH4NO3 ? 2N2 + O2 + 4H2O
d) CaCO3 + H2SO4 ? CaSO4 + CO2 + H2O
e) A? + 3HC? ? A?C?3 + 3H2
19) Uma das maneiras de impedir que o SO2, um dos responsáveis pela chuva ácida, seja liberado para
a atmosfera é tratá-lo previamente com óxido de magnésio em presença de ar. Analisando a equação
dada e, balanceando-a, o menor coeficiente inteiro do oxigênio é:
SO2 + MgO + O2 ? MgSO4
a) 1/2
b) 1
c) 1,5
d) 2
e) 2,5
20) (PUC-MG) A equação não balanceada que representa o ataque do ácido fluorídríco ao vidro,
deixando-o fosco, é a seguinte: HF + SiO2 ? H2SiF6 + H2O
A soma total dos coeficientes mínimos e inteiros das espécies químicas envolvidas, após o
balanceamento da equação, é:
a) 5
b) 7
c) 8
d) 10
e) 12
21) Assinale a alternativa correta com relação à equação abaixo:
2 KClO3 ==> 2 KCl + 3 O2
a) A equação não está balanceada
b) KCl e O2 são os reagentes desta reação
c) A equação está balanceada e KClO3 é o reagente desta reação.
d) KClO3 e O2 e são os produtos desta reação
22) Assinale a alternativa correta com relação à equação abaixo:
MnO2 + HCl ==> MnCl2 + Cl2
a) A equação não está balanceada
b) MnCl2 e HCl são os reagentes desta reação
c) A equação está balanceada.
d) MnO2 e Cl2 são os produtos desta reação.
23) Completando a reação H3PO4 + Ba(OH)2 ==> ............. + H2O e acertando os coeficientes, a alternativa que corresponde aos coeficientes estequiometricamente corretos é:
a) 2, 3, 3, 6.
b) 2, 3, 1, 6.
c) 1, 1, 3, 1.
d) 1, 3, 1, 1.
e) 1, 1, 1, 1.
24) A reação de neutralização total H3PO4 + Ba(OH)2 ==> Ba3(PO4)2 + H2O após ser balanceada apresentará os seguintes coeficientes estequiométricos, respectivamente:
a) 2, 3, 1, 6.
b) 1, 1, 3, 1.
c) 1, 3, 1, 1.
d) 2, 3, 3, 6.
e) 1, 1, 1, 1.
25) Dadas as equações químicas não balanceadas:
Al(OH)3 + H2SO4 ==> Al2(SO4)3 + H2O
C3H8 + O2 ==> CO2 + H2O
As somas dos coeficientes (menores e inteiros possíveis) de cada equação química são, respectivamente:
a) 10 e 11.
b) 10 e 10.
c) 12 e 12.
d) 12 e 13.
e) 15 e 14.
Gabarito:
1) 10HI +3 +2 KMnO4 + H2SO4 ---- 2MnSO4 5I2 8 H2O + K2SO4
2) I. 2 KBrO3 ? 2 KBr +3 O2
II. Análise ou decomposição.
III. A liberação de gás oxigênio
III. A liberação de gás oxigênio
3) B
4) a) 2 Mg (s) + O2 (g) ? 2MgO (s)
b) CH4 (g) + 2 O2 (g) ? CO2 (g) + 2 H2O (l)
c) 1 C2H4 + 3 O2 ? 2 CO2 + 2 H2O
d) 1 C2H6O + 3 O2 ? 2 CO2 + 3 H2O
5) B 6) E 7) D 8) A 9) A 10) C 11) C 12) D 13) 1/5 14) B
15) E 16) a) 1, 3 e 2 b) 2, 1 e 2 c) 1, 1 e 2 d) 1, 5, 3 e 4 e) 2, 1 e 2 f) 1, 2, 1 e 217) D 18) E 19) B 20) D 21) C 22) A 23) B 24) A 25) D
- Biografia, Vida E Realizações De Bhaskara
Bhaskara foi um matemático, professor, astrólogo e astrônomo indiano. É conhecido por ter criado a fórmula matemática aplicada na equação de 2° grau, embora haja controvérsias quanto a esse fato. Viveu de 1114 a 1185...
- Reações Químicas - Resumo (com Questões)
Reações químicas - conceito As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação...
- Número De Oxidação Resumo (com Questões)
Número de oxidaçãoNúmero de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon.O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência...
- Distância Entre Ponto E Reta Questões Vestibular
Artigo sobre distância entre ponto e reta com questões de vestibulares resolvidas. Distância entre ponto e reta Vamos realizar o estudo analítico da distância entre um ponto e uma reta no plano cartesiano. Considere um ponto P(xo, yo) e uma reta...
- Exercícios Resolvidos Equação Geral Da Circunferência
Artigo com exercícios resolvidos equação geral da circunferência 1) Dada a equação x2 + y2 + 2x + 8y + k = 0, obter k para que ela represente: a) uma circunferência; b) um único ponto; c) um conjunto vazio. Resolução 2) Qual das...
