Vestibular
Outros exemplos:
Exemplo: Quando uma lâmina de zinco é introduzida em uma solução aquosa de ácido clorídrico, vai ocorrer a formação de cloreto de zinco e o gás hidrogênio vai ser liberado.
O produto sulfato de bário: BaSO4(s) é um sal branco insolúvel.
b) Decomposição.
c) Simples troca.
d) Dupla troca.
Que é uma reação de:
18) Classifique as reações a seguir:
a) CuCl2 + H2SO4 ? CuSO4 + 2 HCl
19) Associe cada eq. a seguir, ao tipo de reação adiante: Lendo-se corretamente a coluna do tipo de reação, de cima para baixo, obtém-se:
a) 2, 1, 3, 5, 4
b) 5, 3, 1, 2, 4
c) 4, 5, 2, 3, 1
d) 5, 4, 3, 2, 1
e) 1, 5, 2, 3, 4

20) I) P2O5+ 3 H2O ? 2 H3PO4
II) 2 KCgBaCO3 2 KCg + 3 O2
III) 3 CuSO4 + 2 Ag ? Ag2(SO4)3 + 3 Cu.
As reações I, II e III representam, respectivamente:
a) síntese, análise e simples troca.
b) análise, síntese e simples troca.
c) simples troca, análise e análise.
d) síntese, simples troca e dupla troca.
e) dupla troca, simples troca e dupla troca.
a) Decomposição, simples troca, dupla troca, adição.
b) Dupla troca, adição, simples troca, análise.
c) Dupla troca, análise, deslocamento, síntese.
d) Deslocamento, análise, dupla troca, adição.
e) Dupla troca, decomposição, síntese, simples troca.

- Resumo Das Funções Orgânicas
A química orgânica é a química dos compostos de carbono. Antes de mais nada devemos lembrar que o carbono é tetravalente, isto é, realiza 4 ligações covalentes. Antes de começar o resumo, deveremos ter algumas coisas em mente: 1. Classificação...
- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Exercícios Bioquímica
Aqui estão algumas questões de vestibulares sobre Bioquímica. Para conferir o gabarito selecione o texto no final de cada questão (Resposta: letra X). 1. (UNIR/RO) A mandioca, rica em amido, constitui o principal alimento energético de muitas famílias...
- Nomenclatura De ácidos, Bases, Sais E óxidos
ÁCIDOSPara ácidos não oxigenados, usamos a terminação IDRICO. Exemplo:HCl ? ácido clorídricoH2S ? ácido sulfídricoH2Se ? ácido selenídricoPara ácidos oxigenados, a coisa complica um pouco.Se o elemento possuir somente uma...
- O Escambo
NOVAES Carlos Eduardo, LOBO César - História do Brasil para principiantes ?- Editora Ática ? São Paulo ? p.40 A charge faz referência ao período pré-colonial da história do Brasil, quando os portugueses exploravam a mão-de-obra indígena...
Vestibular
Reações químicas - resumo (com questões)
Reações químicas - conceito
As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação química promove mudança na estrutura da matéria.
As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação química promove mudança na estrutura da matéria.
Existem vários critérios para classificar reações químicas, um deles relaciona o número de substâncias que reagem (reagentes) e o número de substâncias produzidas (produtos).
Tipos de reações químicas
As reações químicas são classificadas em : reação de síntese ou adição, reação de análise ou decomposição, reação de deslocamento ou simples-troca e reação de dupla troca.
Tipos de reações químicas
As reações químicas são classificadas em : reação de síntese ou adição, reação de análise ou decomposição, reação de deslocamento ou simples-troca e reação de dupla troca.
1- Reação de síntese ou adição: São aquelas que duas ou mais substâncias originam um único produto.
A + B ? AB
Exemplo dessa reação: quando o magnésio reage com o oxigênio do ar:
2Mg(s) + 1 O2(g) ? 2MgO(s)
Essa reação se faz presente em flashes fotográficos descartáveis e foguetes sinalizadores.
Outros exemplos:
Fe + S 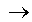 FeS
FeS
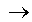 FeS
FeS2H2 + O2 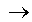 2H2O
2H2O
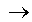 2H2O
2H2O2 - Reações de análise ou decomposição: As reações de análise ou decomposição são o oposto das reações de síntese, ou seja, um reagente dá origem a produtos mais simples que ele. Escrevendo a reação genérica fica fácil entender o que acontece:
AB ? A + B
Exemplo: Os airbags são dispositivos de segurança presentes em vários automóveis. Quando acionamos esse dispositivo, a rápida decomposição do composto de sódio NaN3(s) origina N2(g) que faz inflar os airbags. Veja a reação:
2 NaN3(s) ? 3 N2(g) + 2 Na(s)
Outros exemplos:
2H2O  2 H2 + O2
2 H2 + O2
 2 H2 + O2
2 H2 + O22H2O2  2H2O + O2
2H2O + O2
 2H2O + O2
2H2O + O23 - Reações de deslocamento ou simples-troca: ocorre quando uma substância simples reage com uma composta originando novas substâncias: uma simples e outra composta.
A + XY ? AY + X
Vamos entender o que aconteceu: C trocou de lugar A. Simples assim, mas será que isso ocorre sempre? É intuitivo que não. Iamgine o seguinte: você entra em um baile e vê a pessoa com quem gostaria de dançar dançando com outra pessoa. Você vai até lá e tentará fazê-la mudar de par, ou seja, estará tentando deslocar o acompanhante indesejável e assumir seu lugar. Se você for mais forte que o "indesejável", basta dar-lhe um empurrão e assumir seu lugar mas, se ele for um brutamontes troglodita, possivelmente ele nem sentirá seu empurrão. Na reação de deslocamento o processo é idêntico: C vê B ligado a A, aproxima-se e, sendo mais forte, desloca A e assume a ligação com B. Caso C não seja mais forte que A nada acontece.
Basta então saber que é mais forte que quem:
Exemplo: Quando uma lâmina de zinco é introduzida em uma solução aquosa de ácido clorídrico, vai ocorrer a formação de cloreto de zinco e o gás hidrogênio vai ser liberado.
Zn (s) + 2 HCl (aq) ? ZnCl2(aq) + H2 (g)
Observe que o Zinco deslocou o Hidrogênio, daí o porque do nome ?reação de deslocamento?.
Outros exemplos:
2Na + 2H2O 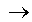 2NaOH + H2 (o sódio desloca o hidrogênio da água H-OH)
2NaOH + H2 (o sódio desloca o hidrogênio da água H-OH)
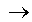 2NaOH + H2 (o sódio desloca o hidrogênio da água H-OH)
2NaOH + H2 (o sódio desloca o hidrogênio da água H-OH)Au + HCl 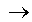 não reage (o ouro não consegue deslocar o hidrogênio)
não reage (o ouro não consegue deslocar o hidrogênio)
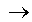 não reage (o ouro não consegue deslocar o hidrogênio)
não reage (o ouro não consegue deslocar o hidrogênio)4 - Reação de dupla troca: dois reagentes reagem formando dois produtos, ou seja, se duas substâncias compostas reagirem dando origem a novas substâncias compostas recebem essa denominação.
AB + CD ? AD + CB
Exemplo: a reação entre o ácido sulfúrico com hidróxido de bário produz água e sulfato de bário.
H2SO4 (aq) + Ba(OH)2(aq) ? 2 H2O(l) + BaSO4(s)
O produto sulfato de bário: BaSO4(s) é um sal branco insolúvel.
Outros exemplos:
NaOH + HCl 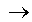 NaCl + H2O
NaCl + H2O
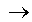 NaCl + H2O
NaCl + H2ONaCl + LiNO3 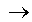 NaNO3 + LiCl
NaNO3 + LiCl
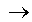 NaNO3 + LiCl
NaNO3 + LiClFontes:http://www.brasilescola.com / http://br.syvum.com / http://educacao.uol.com.br/
Exercícios sobre tipos de reações químicas
Classifique as reações químicas abaixo:
1) 6 H3BO3 ==> H4B6O11 + 7 H2O
a) Síntese.b) Decomposição.
c) Simples troca.
d) Dupla troca.
2) 2 N2 + O2 ==> 2 N2O
a) Síntese.
b) Dupla troca.
c) Decomposição.
d) Dupla troca
3) 3 Ca + 2 AlCl3 ==> 3 CaCl2 + 2 Al
a) Dupla troca.
b) Síntese.
c) Simples troca.
d) Decomposição.
4) 3 BaCl2 + Al2(SO4)3 ==> 3 BaSO 4 + 2 AlCl3
a) Síntese.
b) Simples troca.
c) Decomposição.
d) Dupla troca.
5) 2 HCl + Ca(OH)2 ==> CaCl2 + 2 H2O
a) Decomposição.
b) Síntese.
c) Dupla troca.
d) Simples troca.
6) P4 + 5 O2 ==> 2 P2O5
a) Síntese.
b) Dupla troca.
c) Simples troca.
d) Decomposição.
7) Ferro + ácido Sulfúrico ---> sulfato Ferroso + Hidrogênio [Fe + H2SO4 ---> FeSO4 + H2] é um exemplo de Adicionar pergunta à Lista de Revisão
a) reação de decomposição
b) reação de síntese ou combinação direta
c) reação de simples troca
d) reação de dupla troca.
8) CaBr2 + 2 AgNO3 ==> 2 AgBr + Ca(NO3)2
a) Simples troca.
b) Decomposição.
c) Síntese.
d) Dupla troca.
9) Carbonato de Cobre (+ calor) ---> óxido de Cobre + dióxido de Carbono [CuCO3 ---> CuO + CO2] é um exemplo de:
a) reação de síntese ou combinação direta
b) reação de decomposição
c) reação de simples troca
d) reação de dupla troca.
10) Cloreto de Potássio + nitrato de Prata ---> nitrato de Potássio + cloreto de Prata [KCl + AgNO3 ---> KNO3 + AgCl] é um exemplo de Adicionar pergunta à Lista de Revisão
a) reação de simples troca
b) reação de dupla troca
c) reação de decomposição
d) reação de síntese ou combinação direta.
11) Água (+ corrente elétrica) ---> Hidrogênio + Oxigênio [2 H2O ---> 2 H2 + O2] é um exemplo de
a) reação de simples troca
b) reação de síntese ou combinação direta
c) reação de decomposição
d) reação de dupla troca.
12) Magnésio + sulfato de Cobre ---> sulfato de Magnésio + Cobre [Mg + CuSO4 ---> MgSO4 + Cu] é um exemplo de
a) reação de decomposição
b) reação de síntese ou combinação direta
c) reação de dupla troca
d) reação de simples troca.
13) Zinco + ácido Hidroclórico ---> cloreto de Zinco + Hidrogênio [Zn + 2 HCl ---> ZnCl2 + H2] é um exemplo de:
a) reação de síntese ou combinação direta
b) reação de dupla troca
c) reação de simples troca
d) reação de decomposição.
14) Ferro + Enxofre ---> sulfeto de Ferro [Fe + S ---> FeS] é um exemplo de
a) reação de simples troca
b) reação de decomposição
c) reação de síntese ou combinação direta
d) reação de dupla troca.
15) óxido de Sódio + Água ---> hidróxido de Sódio [Na2O + H2O ---> 2 NaOH] é um exemplo de:
a) reação de decomposição
b) reação de síntese ou combinação direta
c) reação de simples troca
d) reação de dupla troca.
16) (UFRJ) A reação que representa a formação do cromato de chumbo II, que é um pigmento amarelo usado em tintas, é representada pela eq. abaixo:
Pb(CH3COO)2 + Na2CrO4 ? PbCrO4 + 2 NaCH3COO
Que é uma reação de:
a) oxirredução
b) dupla troca
c) síntese
d) deslocamento
e) decomposição.
17) Dê nomes às reações (reação de síntese, decomposição, simples troca ou dupla troca), de acordo com os reagentes e produtos, justificando a resposta:
a) Zn + Pb(NO3)2 ? Zn(NO3)2 + Pb
b) FeS + 2 HCl ? FeCl2 + H2S
c) 2 NaNO3 ? 2 NaNO2 + O2
d) N2 + 3 H2 ? 2 NH3
a) CuCl2 + H2SO4 ? CuSO4 + 2 HCl
b) Zn + 2 HCl ? ZnCl2 + H2
c) P2O5 + 3 H2O ? 2 H3PO4
d) CuSO4 + 2 NaOH ? Cu(OH)2 + Na2SO4
e) Cu(OH)2 ? CuO + H2O
f) AgNO3 + NaCl ? AgCl + NaNO3
g) CaO + CO2 ? CaCO3
h) 2 H2O ? 2 H2 + O2
i) Cu + H2SO4 ? CuSO4 + H2
j) 2 AgBr ? 2 Ag + Br
19) Associe cada eq. a seguir, ao tipo de reação adiante: Lendo-se corretamente a coluna do tipo de reação, de cima para baixo, obtém-se:
a) 2, 1, 3, 5, 4
b) 5, 3, 1, 2, 4
c) 4, 5, 2, 3, 1
d) 5, 4, 3, 2, 1
e) 1, 5, 2, 3, 4

20) I) P2O5+ 3 H2O ? 2 H3PO4
II) 2 KCgBaCO3 2 KCg + 3 O2
III) 3 CuSO4 + 2 Ag ? Ag2(SO4)3 + 3 Cu.
As reações I, II e III representam, respectivamente:
a) síntese, análise e simples troca.
b) análise, síntese e simples troca.
c) simples troca, análise e análise.
d) síntese, simples troca e dupla troca.
e) dupla troca, simples troca e dupla troca.
21) Fazendo-se a classificação das reações abaixo:
(I) CuSO4 + 2NaOH ? Cu(OH)2 + Na2SO4
(II) Cu(OH)2 ? CuO + H2O
(III) Zn + 2AgNBaCO3 ? 2Ag + Zn(NBaCO3)2
(IV) NH3 + HCl ? NH4ClA
A ordem correta é:
a) Decomposição, simples troca, dupla troca, adição.
b) Dupla troca, adição, simples troca, análise.
c) Dupla troca, análise, deslocamento, síntese.
d) Deslocamento, análise, dupla troca, adição.
e) Dupla troca, decomposição, síntese, simples troca.
22) CaO + H2O ? Ca(OH)2. Essa reação pode ser classificada de:a) síntese
b) simples troca
c) dupla troca
d) análise
e) decomposição.
b) simples troca
c) dupla troca
d) análise
e) decomposição.
23) H2SO4 + CaO ? CaSO4 + H2O. A reação é classificada como sendo de: a) análise
b) síntese
c) decomposição
d) simples-troca
e) dupla-troca.
b) síntese
c) decomposição
d) simples-troca
e) dupla-troca.
24) I - Zn + 2AgNBaCO3 ? 2Ag + Zn(NBaCO3)2II - (NH4)2Cr2O? ? N2+ + Cr2BaCO3 + 4H2OIII - 2Mg + O2 ? 2MgOIV - Cl2 + 2NaBr ? Br2 + 2NaCgV - H2SO4 + Na2CBaCO3 ? Na2SO4+ H2O + CO2. Dadas as reações acima, indique a opção que apresenta a ordem correta de suas classificações.a) Deslocamento; decomposição; síntese; deslocamento; dupla-troca.
b) Deslocamento; síntese; decomposição; deslocamento; dupla-troca.
c) Dupla-troca; decomposição; síntese; dupla-troca; deslocamento.
d) Dupla-troca; síntese; decomposição; dupla-troca; deslocamento.
e) Síntese; decomposição; deslocamento; dupla-troca; dupla-troca.
25) Dentre as eq. abaixo, a única que representa uma síntese é:
a) H2 + 1/2 O2 + descarga elétrica ? H2O
b) NaBr + AgNBaCO3 ? AgBr + NaNBaCO3
c) Hg2O ì 2 Hg + 1/2 O2
d) 2 NaI + Cl2 ? 2 NaCg + I2
e) CH4 + 2 O2 ì CO2 + 2 H2O
Gabarito:
b) Deslocamento; síntese; decomposição; deslocamento; dupla-troca.
c) Dupla-troca; decomposição; síntese; dupla-troca; deslocamento.
d) Dupla-troca; síntese; decomposição; dupla-troca; deslocamento.
e) Síntese; decomposição; deslocamento; dupla-troca; dupla-troca.
25) Dentre as eq. abaixo, a única que representa uma síntese é:
a) H2 + 1/2 O2 + descarga elétrica ? H2O
b) NaBr + AgNBaCO3 ? AgBr + NaNBaCO3
c) Hg2O ì 2 Hg + 1/2 O2
d) 2 NaI + Cl2 ? 2 NaCg + I2
e) CH4 + 2 O2 ì CO2 + 2 H2O
Gabarito:
1) B 2) A 3) C 4) D 5) C 6) A 7) C 8) D 9) B 10) B 11) C 12) D
13) C 14) C 15) B 16) B
17) a) A equação acima se refere a uma reação de simples troca (ou deslocamento): uma substância simples (Zn) reagiu com uma composta Pb(NO3)2 e originou uma nova substância simples (Pb) e outra composta Zn(NO3)2.
b) Reação de dupla troca: duas substâncias compostas reagiram entre si originando duas novas substâncias compostas.
c) Reação de decomposição (ou análise): uma única substância (NaNO3) originou dois produtos.
d) Reação de síntese (ou adição): duas substâncias originaram um único produto (NH3).
c) Reação de decomposição (ou análise): uma única substância (NaNO3) originou dois produtos.
d) Reação de síntese (ou adição): duas substâncias originaram um único produto (NH3).
18) a) Reação de dupla troca
b) Reação de simples troca
c) Reação de síntese
d) Reação de dupla troca
e) Reação de decomposição
f) Reação de dupla troca
g) Reação de síntese
h) Reação de análise (decomposição)
i) Reação de simples troca
j) Reação de decomposição
19) C 20) A 21) C 22) A 23) E 24) A 25) A
b) Reação de simples troca
c) Reação de síntese
d) Reação de dupla troca
e) Reação de decomposição
f) Reação de dupla troca
g) Reação de síntese
h) Reação de análise (decomposição)
i) Reação de simples troca
j) Reação de decomposição
19) C 20) A 21) C 22) A 23) E 24) A 25) A

- Resumo Das Funções Orgânicas
A química orgânica é a química dos compostos de carbono. Antes de mais nada devemos lembrar que o carbono é tetravalente, isto é, realiza 4 ligações covalentes. Antes de começar o resumo, deveremos ter algumas coisas em mente: 1. Classificação...
- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Exercícios Bioquímica
Aqui estão algumas questões de vestibulares sobre Bioquímica. Para conferir o gabarito selecione o texto no final de cada questão (Resposta: letra X). 1. (UNIR/RO) A mandioca, rica em amido, constitui o principal alimento energético de muitas famílias...
- Nomenclatura De ácidos, Bases, Sais E óxidos
ÁCIDOSPara ácidos não oxigenados, usamos a terminação IDRICO. Exemplo:HCl ? ácido clorídricoH2S ? ácido sulfídricoH2Se ? ácido selenídricoPara ácidos oxigenados, a coisa complica um pouco.Se o elemento possuir somente uma...
- O Escambo
NOVAES Carlos Eduardo, LOBO César - História do Brasil para principiantes ?- Editora Ática ? São Paulo ? p.40 A charge faz referência ao período pré-colonial da história do Brasil, quando os portugueses exploravam a mão-de-obra indígena...

