Vestibular


- Propriedades Da Água E Sais Minerais
1. Qual é a porcentagem aproximada (em massa) de água presente no corpo humano? Essa porcentagem é maior nos indivíduos jovens ou adultos?Aproximadamente 65% da massa do corpo humano é água. No cérebro, por exemplo, cerca de 90% de sua massa é...
- Proteína Que Se Encontra Em Corais Australianos Barra Vírus Da Aids
Uma classe de proteína que se encontra em corais das águas australianas impede que o vírus da sida penetre nas células do sistema imunitário humano, revela um estudo apresentado na terça-feira num congresso nos Estados Unidos. As proteínas em...
- Descoberto Processo Celular Fundamental Que Poderá Estar Associado A Doenças Humanas
Muitos dos genes ? e, portanto, das proteínas ? da humilde levedura do padeiro (Saccharomyces cerevisiae) possuem versões humanas. E, aproveitando a simplicidade do ADN da levedura, uma equipa liderada por Tiago Outeiro ? do Instituto de Medicina...
- Canela Pode Prevenir Mal De Alzheimer
Pesquisadores da Universidade da Califórnia (UCLA), em Santa Barbara, Estados Unidos, estão estudando a canela, uma casca aromática, usada em diferentes pratos e infusões. O objetivo é estabelecer sua possível ação no combate a doenças comuns...
- Componentes Celulares E Suas Funções
Componentes celulares e suas funções Membrana plasmática A membrana plasmática envolve a célula e isola o citoplasma do meio extracelular. É formada por duas camadas de lipídios (moléculas insolúveis na água) e proteínas, sendo, por isso,...
Vestibular
Proteínas
1. O que são proteínas? Como a diversidade de proteínas nos seres vivos pode ser explicada?
Proteínas são moléculas construídas por sequências de aminoácidos que se unem por ligações peptídicas.
O código genético codifica vinte diferentes tipos de aminoácidos que compõe as proteínas. Existem numerosas combinações desses vintes aminoácidos, onde cada uma, forma sequencias de polipeptídios (proteínas) e exatamente por isso é possível encontrar uma enorme diversidade de proteínas.
2. Qual a importância das proteínas para os organismos?
As proteínas estão envolvidas em muitos processos fundamentais dentro dos organismos. Devido a sua diversidade, as proteínas podem assumir diferentes formas para participar dos processos biológicos das células e tecidos.
Entre os processos executados pelas proteínas estão: estrutural (membrana plasmática, citoesqueleto, conexão de tecidos), enzimática (as enzimas são proteínas), energética (as proteínas podem ser quebradas em acetil-CoA e participar do ciclo de Krebs), regulação osmótica (a proteína albumina é muito importante neste processo), transporte (canais da membrana, pigmentos respiratórios), imunológica (os anticorpos são proteínas), movimentação (proteínas contráteis como a miosina), endócrina (muitos hormônios são proteínas) e informativa (sinalizadores de membrana plasmática).
3. Qual é a unidade constitucional das proteínas?
A unidade constitucional das proteínas são os aminoácidos.
4. O que é um oligopeptídio? Qual a diferença deste para um polipeptídio?
Os peptídeos são moléculas formadas por aminoácidos unidos por ligações peptídicas. O oligopeptídio é um peptídeo formado pela união de poucos aminoácidos (oligo=pouco). Já os polipeptídios são peptídeos formados por muitos aminoácidos (poli=muitos), em geral, mais que 50.
5. Quantos são os aminoácidos que formam as proteínas dos seres vivos?
Existem vinte diferentes tipos de aminoácidos conhecidos. Eles se combinam de diferentes formas para formar as proteínas. Essas combinações são ditadas pelo código genético. Porém existe uma infinidade de aminoácidos que ainda não foram descobertos.
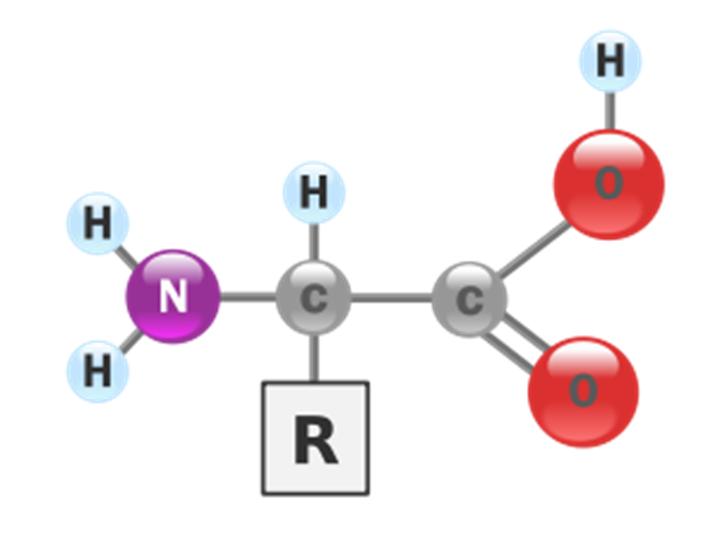
6. Todo aminoácido possui um carbono central? A quais grupos de moléculas orgânicas este carbono central se liga?
Sim, todos eles possuem um carbono central que se liga a um grupo amina ?NH2, a um átomo de hidrogênio ?H e um radical que varia ?R.

Estrutura da molécula de aminoácido
7. Como o grupo amina pode ser classificado?
As aminas podem ser classificadas em aminas primárias, aminas secundárias e aminas terciárias. As aminas primárias são aquelas onde o radical variável (?R) está ligado no grupo amina (-NH2). As aminas secundárias que são aquelas onde um dos hidrogênios do grupo amina (-NH2) é substituído por outro radical variável (-R) ficando assim com dois radicais variáveis (-R). E as aminas terciárias são aquelas no qual os dois hidrogênios do grupo amina são substituídos por dois radicais variáveis.

Estrutura química dos diferentes tipos de aminas
8. Qual é a representação estrutural do grupo carboxila?
Os grupos carboxila possuem um carbono ligado a um grupo hidroxila por uma simples ligação e a um oxigênio por uma dupla ligação.

Grupo Carboxila
9. Qual a representação estrutural de uma molécula de aminoácido?
O aminoácido possui um carbono central ligado em um dos lados a um grupo carboxila e na sua outra extremidade a um radical variável (-R). Já na posição perpendicular este carbono se liga a um grupo amina (-NH2) e na outra extremidade liga-se a uma molécula de hidrogênio.
O hidrogênio presente no grupo hidroxila que se liga ao carbono central é quem dá o nome ?ácido? a molécula. Já o grupo amina ligado a este mesmo carbono central é quem da o nome ?amino?, assim surge o nome aminoácido.
10. Qual é a importância do grupo ?R (radical variável) na molécula de aminoácido?
O grupo ?R, também chamado de cadeia lateral, é uma parte variável da molécula de aminoácido. O grupo ?R pode ser uma cadeia carbônica complexa, um grupo metil (formando o aminoácido alanina) ou mesmo um simples hidrogênio (formando a glicina, o mais simples dos aminoácidos). O grupo ?R é importante, pois ele é o fator de diferenciação dos aminoácidos.
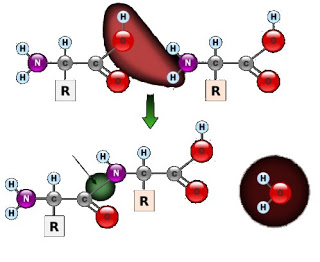
11. Como a ligação entre dois aminoácidos para a formação do peptídeo pode ser descrita?
Um peptídeo é formado quando um carbono do grupo hidroxila de um dos aminoácidos é conectado com o nitrogênio do grupo amina do outro aminoácido. Durante o processo de formação desta ligação a hidroxila do grupo carboxil e um hidrogênio da amina são perdidos resultando na liberação de uma molécula de água.
12. Como é chamada a ligação entre dois aminoácidos?
A ligação química entre dois aminoácidos é chamada de ligação peptídica.

Esquematização de como ocorre a ligação peptídica
13. O grupo ?R ligado ao carbono central do aminoácido participa da união entre dois aminoácidos?
Não, o grupo ?R não participa da ligação peptídica.
14. O ?H (hidrogênio) ligado ao carbono central do aminoácido participa da união entre dois aminoácidos?
Não, o ?H (hidrogênio) na participa da ligação peptídica.
15. O grupo amina e o grupo carboxila ligados ao carbono central participam da união entre dois aminoácidos?
Sim. O nitrogênio do grupo amina de um aminoácido se liga ao carbono do grupo carboxila do outro aminoácido. A molécula de água liberada no processo de formação do peptídeo possui um hidrogênio vindo da amina e um oxigênio e o outro hidrogênio vindo do grupo carboxila.
16. A reação química que ocorre na união dos aminoácidos incorpora ou libera átomos? Quais são as estruturas químicas incorporadas ou liberadas nesta reação?
A união dos aminoácidos (ligação peptídica) libera átomos. Eles são liberados como constituintes da molécula água.
17. Existem diferentes proteínas formadas pela mesma quantidade de aminoácidos?
Diferentes tipos de proteínas com a mesma quantidade de aminoácidos podem existir. Nestes casos a diferenciação é dada pelo tipo de aminoácido ou pela sequencia deles na formação das proteínas.
18. As proteínas com a mesma quantidade dos mesmos aminoácidos formam necessariamente proteínas idênticas?
Muitas proteínas possuem o mesmo número de um determinado tipo de aminoácido em sua constituição, como por exemplo, 50 alaninas, 70 glicinas e 20 histidinas, porém, a sequencia que cada um desses aminoácidos se posiciona pode ser muito diferente. Logo, mesmo que duas ou mais proteínas possuam a mesma quantidade de determinados tipos de aminoácidos elas necessariamente não precisam ser idênticas.
19. Qual é a condição essencial para que uma proteína seja idêntica a outra?
Para que uma proteína seja idêntica a outra é necessário que a sequência de aminoácidos seja a mesma.
20. O que é a estrutura primária da proteína? Qual é a importância da estrutura primária?
A estrutura primária de uma proteína é uma sequencia linear de aminoácidos. A estrutura primária é a base da identidade da proteína. A modificação de um único aminoácido desta cadeia já cria uma proteína diferente. Esta proteína diferenciada pode ser inativa ou mesmo adquirir uma nova função.
21. O que é a estrutura secundária de uma proteína?
A estrutura secundária de uma proteína é gerada a partir da interação molecular entre os aminoácidos da cadeia. Estas interações formam uma conformação espacial da cadeia do polipeptídio. Estas duas conformações secundárias são chamadas de alfa hélice e folha beta.
22. Qual é a diferença entre a estrutura secundária alfa hélice e folha beta?
As conformações alfa hélice e folha beta são dois tipos de estruturas secundárias das proteínas. Dependendo do tipo de estrutura primária a estrutura secundária pode ser de um tipo ou de outro.
Na estrutura alfa hélice o polipeptídio se curva longitudinalmente pela ação das ligações de hidrogênio formando um espiral, uma hélice. Na estrutura folha beta, a conformação da proteína é mais estendida e as ligações de hidrogênio formam um ziguezague.
23. O que é a estrutura terciária da proteína? Quais são os principais tipos de estruturas terciárias?
A estrutura terciária da proteína é uma conformação espacial originada a partir da estrutura secundária em que a alfa hélice ou a folha beta se entrelaçam ainda mais.
As forças que formam a estrutura terciária geralmente são interações entre os grupos ?R dos aminoácidos e entre outras partes da proteína e as moléculas de água da solução.
Os principais tipos de proteínas de estrutura terciária são as globulares e fibrosas.
24. O que é a estrutura quaternária das proteínas? Todas as proteínas possuem estrutura quaternária?
A estrutura quaternária da proteína é formada pela interação entre as cadeias de polipeptídios que formam as proteínas.
Todas as proteínas que são formadas por duas ou mais cadeias de polipeptídios possuem estrutura quaternária. A insulina, por exemplo, possui duas cadeias. Outros exemplos de proteínas com estrutura quaternária são a hemoglobina (quatro cadeias) e as imunoglobulinas (anticorpos com quatro cadeias).
Estruturas das proteínas (em inglês)
25. O que é desnaturação proteica? Existe alguma chance da estrutura primária da proteína ser desnaturada?
Proteínas de estruturas secundárias, terciárias e quaternárias são estruturas espaciais. A desnaturação é a modificação de qualquer uma dessas estruturas que fazem com que a proteína seja biologicamente inativa. A estrutura primária da proteína não é afetada.
26. O processo de desnaturação proteica pode ser reversível?
A desnaturação da proteína pode ou não ser reversível, ou seja, algumas proteínas podem retornar ao seu estado espacial original.
27. Quais são os fatores que podem ocasionar a desnaturação proteica?
A desnaturação das proteínas pode ser causada pela variação da temperatura, do PH, mudanças na concentração de solutos no meio em que a proteína está inserida e em muitos outros processos. A maioria das proteínas desnatura depois da elevação da temperatura ou quando a solução está muito ácida ou muito básica. Estas são as principais razões pelas quais o organismo necessita manter a estabilidade da temperatura e do PH interno.
28. É esperado que uma mudança na cadeia primária, secundária ou terciária da proteína possa produzir consequências no funcionamento do organismo?
Qualquer alteração na conformação espacial da proteína pode causar alterações importantes na função biológica. As modificações na estrutura primária da proteína são mais importantes, pois são modificações na composição das moléculas que são responsáveis pelas outras conformações espaciais da proteína.
29. Na anemia falciforme, uma doença hereditária, ocorre a substituição de um aminoácido por outro em uma das quatro cadeias de polipeptídios que formam a hemoglobina. Neste caso todas as estruturas da proteína são modificadas?
Na anemia falciforme há uma mudança em uma estrutura primária de uma das proteínas que formam a hemoglobina. O aminoácido ácido glutâmico é substituído pelo aminoácido valina na cadeia beta. A conformação espacial da molécula é afetada e modificada por este erro ?primário? e este erro acaba por consequência causando uma alteração na forma da proteína e da própria célula sanguínea.
Está modificação no glóbulo vermelho (célula sanguínea) obstrui a circulação periférica de sangue, causando hipóxia do tecido e crises de dores no corpo.
Como fritar um ovo sem usar fogo?
30. Qual é diferença entre aminoácidos essenciais e naturais?
Os aminoácidos essenciais são aqueles em que o organismo não esta preparado para sintetizar e precisa que estes sejam ingeridos pelo individuo. Os aminoácidos naturais são aqueles em que o organismo tem autonomia na produção.
Existem algumas espécies que produzem todos os aminoácidos de que precisam, como por exemplo, a bactéria Escherichia coli, que não tem aminoácidos essenciais. Outras espécies, como é o caso dos humanos, precisam obter os aminoácidos essências na dieta. Dos vinte diferentes tipos de aminoácidos conhecidos que formam as proteínas humanas, doze são naturais e oito precisam ser retirados dos alimentos que são consumidos.
Os aminoácidos essenciais para os humanos são a fenilalanina, histidina, isoleucina, lisina, metionina, treonina, triptofano e valina.
31. Quais são as funções exercidas pelas seguintes proteínas: miosina, CD4, albumina, queratina, imunoglobulina, transcriptase reversa, hemoglobina e insulina?
A miosina é uma proteína que quando associada com a proteína actina produz a contração dos músculos.
A CD4 é uma proteína de membrana de alguns linfócitos, as células que são infectadas pelo vírus HIV.
Albumina é uma proteína de função energética e importante regulador da osmolaridade do sangue.
A Queratina é uma proteína com função estrutural presente na epiderme e seus anexos nos vertebrados.
Imunoglobulinas são os anticorpos, proteínas específicas de ataque e imobilização de corpos estranhos (antígenos) que entram no organismo.
A Transcriptase Reversa é a enzima responsável pela transcrição do RNA e formação do DNA no ciclo de vida dos retrovírus.
A Hemoglobina é uma proteína que carrega o oxigênio dos pulmões para as células.
A Insulina é o hormônio secretado pelo pâncreas que participa do metabolismo da glicose.
- Propriedades Da Água E Sais Minerais
1. Qual é a porcentagem aproximada (em massa) de água presente no corpo humano? Essa porcentagem é maior nos indivíduos jovens ou adultos?Aproximadamente 65% da massa do corpo humano é água. No cérebro, por exemplo, cerca de 90% de sua massa é...
- Proteína Que Se Encontra Em Corais Australianos Barra Vírus Da Aids
Uma classe de proteína que se encontra em corais das águas australianas impede que o vírus da sida penetre nas células do sistema imunitário humano, revela um estudo apresentado na terça-feira num congresso nos Estados Unidos. As proteínas em...
- Descoberto Processo Celular Fundamental Que Poderá Estar Associado A Doenças Humanas
Muitos dos genes ? e, portanto, das proteínas ? da humilde levedura do padeiro (Saccharomyces cerevisiae) possuem versões humanas. E, aproveitando a simplicidade do ADN da levedura, uma equipa liderada por Tiago Outeiro ? do Instituto de Medicina...
- Canela Pode Prevenir Mal De Alzheimer
Pesquisadores da Universidade da Califórnia (UCLA), em Santa Barbara, Estados Unidos, estão estudando a canela, uma casca aromática, usada em diferentes pratos e infusões. O objetivo é estabelecer sua possível ação no combate a doenças comuns...
- Componentes Celulares E Suas Funções
Componentes celulares e suas funções Membrana plasmática A membrana plasmática envolve a célula e isola o citoplasma do meio extracelular. É formada por duas camadas de lipídios (moléculas insolúveis na água) e proteínas, sendo, por isso,...
