Vestibular
Concentração em quantidade de matéria
A concentração em quantidade de matéria consiste na relação entre a quantidade de matéria do soluto, expressa em mols, e o volume da solução em litros.

No entanto, em alguns problemas a quantidade de matéria é expressa em gramas e não em mol. Assim, é necessário fazer as devidas conversões ou utilizar a seguinte fórmula matemática deduzida abaixo: 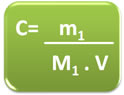
Vejamos um exemplo que pode ser resolvido trabalhando com a concentração em mol/L:
?Qual é a concentração em quantidade de matéria por volume de uma solução de cloreto de potássio que apresenta 18,5 g de KCl em 250 mL de solução??
Primeiramente, para resolver esse problema, é necessário transformar o volume da solução de mililitros para litros:
Ex 2: ?Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume??

Exercícios sobre concentração em quantidade de matéria
1) (Fuvest-SP) A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 · 10?5 mol/litro. Se uma pessoa tomar 3,0 litros dessa água por dia, ao fim de um dia, a massa de fluoreto, em miligramas, que essa pessoa ingeriu é igual a: (massa molar do fluoreto: 19,0 g/mol)
Alternativa ?c?
2) Uma solução de 368 g de glicerina (C3H8O3) em 1600 g de água apresenta densidade de 1,044 g/cm3. Calcule a concentração em mol/L dessa solução. Dados: massas atômicas: H = 1; C = 12; O =16.
Resolução:
3) Qual massa de ácido sulfúrico (H2SO4) será necessária para preparar 2 litros de uma solução na concentração de 3 mol/L? Dado: M(H2SO4)= 98 g/mol.
Resolução:
4) Qual será a concentração em quantidade de matéria de uma solução que foi preparada dissolvendo-se 120 g de hidróxido de sódio em 2 L de água e obteve-se uma solução com 2 L??
Resolução:
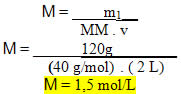
5) 10,00 mL de uma solução de (NH4)2SO4 foram tratados com excesso de NaOH. O gás NH3 liberado foi absorvido em 50,00 mL de uma solução 0,10 mol.L-1 de HC?. O HC? que sobrou foi neutralizado por 21,50 mL de uma solução 0,10 mol.L-1 de NaOH. Qual a concentração da solução de (NH4)2SO4 em mol.L-1?
a) 0,28
b) 0,14
c) 0,32
d) 0,42
e) 0,50
6) (PUC-RIO 2008) É possível conhecer a concentração de uma espécie iônica em solução aquosa, a partir do conhecimento da concentração de soluto e se o soluto dissolvido dissocia-se ou ioniza-se por completo. Uma solução de sulfato de sódio, Na2SO4 possui concentração em quantidade de matéria igual 0,3 mol L?1. Nessa solução, a concentração, em quantidade de matéria, da espécie Na+ é:
a) 0,2 mol L-1
b) 0,3 mol L-1
c) 0,6 mol L-1
d) 0,8 mol L-1
e) 0,9 mol L-1
7) Uma solução de ácido clorídrico a 10% em massa tem densidade 1,05 g/mL.Qual a concentração dessa solução em g/L ? C=105 g/l
8) Que volume de uma solução 0,778 mol/L Na2CO3 deveria ser diluído até 150 mL com água para reduzir sua concentração a 0,234 mol/L? v= 4,51 mL
- Exercícios Resolvidos Calorimetria
Calor(1) Para derreter uma barra de um material w de 1kg é necessário aquecê-lo até a temperatura de 1000°C. Sendo a temperatura do ambiente no momento analisado 20°C e o calor específico dew=4,3J/kg.°C, qual a quantidade de calor necessária...
- Questões Resolvidas De Vestibulares Sobre Hidrostática
Questões resolvidas de vestibular sobre Hidrostática - massa específica, densidade, pressão, pressão atmosférica e empuxo 1) (FCC 2005) Para responder as questões de números I e II considere uma piscina com as seguintes dimensões: comprimento:...
- Fazer Xixi No Mar é Melhor Do Que Se Pensa
Fim-de-semana de verão. Parece que todo o país foi para a praia. O areal está cheio e nada melhor do que um mergulho no mar para refrescar ideias e impedir o cérebro de derreter. A água entorpece os sentidos e a bexiga 'aperta'. Em princípio,...
- área Do Quadrado Questões Vestibular
Para calcular a área de um quadrado, basta elevar ao quadrado a medida de um lado, ou seja, S = L²Exemplo: O lado de um quadrado mede 6 cm. calcule sua área.S = L²S= 6²S= 36 cm Quando dispomos da medida das diagonais do quadrado,...
- área Do Quadrado Questões Vestibular
Artigo sobre área do quadrado com questões de fixação. Para calcular a área de um quadrado, basta elevar ao quadrado a medida de um lado, ou seja, S = L²Exemplo: O lado de um quadrado mede 6 cm. calcule sua área.S = L²S= 6²S=...
Vestibular
concentração em quantidade de matéria resumo (com questões)
Concentração em quantidade de matéria
Dessa forma, a concentração em quantidade de matéria indica a quantidade de matéria presente em um litro da solução; por isso sua unidade é mol/L.
Essa grandeza das soluções químicas também é denominada molaridade, concentração molar, ou, ainda, concentração em mol/L. Essa última expressão e a que está sendo usada no título deste texto são as formas recomendadas pela IUPAC (União Internacional da Química Pura e Aplicada) e pelo SI (Sistema Internacional de Unidades).
Matematicamente, temos:

- Sabendo que a fórmula da quantidade de matéria (n1) é dada por:
n1 = m1
M1
M1
Onde:
m1= massa em gramas do soluto;
M1= massa molar do soluto em gramas por mol (g/mol).
M1= massa molar do soluto em gramas por mol (g/mol).
- Substituindo n1 na fórmula da concentração em mol/L, temos:
C = n1
V
V

?Qual é a concentração em quantidade de matéria por volume de uma solução de cloreto de potássio que apresenta 18,5 g de KCl em 250 mL de solução??
Primeiramente, para resolver esse problema, é necessário transformar o volume da solução de mililitros para litros:
1 L-----1000 mL
V ----- 250 mL
V = 0,25 L
V ----- 250 mL
V = 0,25 L
Visto que não foi dada a quantidade de matéria em mols e sim em gramas, iremos usar a segunda expressão matemática mencionada no texto e substituir nela esses valores. A massa molar do KCl é conseguida olhando-se as massas atômicas de cada elemento numa tabela periódica e somando-se os seus valores:
M1(KCl) = 39,1 + 35, 5 = 74,6 g/mol
C = __m1___
M1 . V
M1 . V
C = ___18,5 g_________
74,6 g/mol . 0,25 L
74,6 g/mol . 0,25 L
C = 1,0 mol/L
Ex 2: ?Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume??
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
V ------ 100 mL
V = 0,1 L
V ------ 100 mL
V = 0,1 L
Também é necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso saber os valores das massas atômicas de ambos os elementos e realizar o cálculo da massa molar ensinado no texto ?Massa Molar e Número de Mol?:
M (NaCl) = 1 . 23+ 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora sim podemos substituir todos os valores na fórmula e descobrir o valor da concentração em mol/L:

1) (Fuvest-SP) A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 · 10?5 mol/litro. Se uma pessoa tomar 3,0 litros dessa água por dia, ao fim de um dia, a massa de fluoreto, em miligramas, que essa pessoa ingeriu é igual a: (massa molar do fluoreto: 19,0 g/mol)
a) 0,9. b) 1,3. c) 2,8. d) 5,7. e) 15.
Resolução:
- Dados do exercício:
m1 = ? (é o que se quer encontrar)
M1= 19,0 g/mol
V (L) = 3 L
M = 5 . 10-5 mol/L
Aplicando os dados na fórmula da concentração em mol/L, temos:
M = __m1__
M1 . V(L)
M1 . V(L)
m1 = M . M1 . V(L)
m1 = 5 . 10-5 mol/L . 19,0 g/mol . 3 L
m1 = 285 . 10-5 g ou
m1 = 2,85 . 10-3 g, que é o mesmo que 2,85 mg.
Alternativa ?c?
2) Uma solução de 368 g de glicerina (C3H8O3) em 1600 g de água apresenta densidade de 1,044 g/cm3. Calcule a concentração em mol/L dessa solução. Dados: massas atômicas: H = 1; C = 12; O =16.
Resolução:
A fórmula da concentração em mol/L ou molaridade (M) é:
M = __m1__
M1 . V(L)
M1 . V(L)
Onde,
m1 = massa do soluto (da glicerina);
M1= massa molar do soluto;
V (L) = volume da solução em litros.
Para usar essa fórmula, precisamos descobrir primeiro V e M1. A massa molar da glicerina é calculada normalmente:
M1(C3H8O3)= (3 . 12) + (8 . 1) + (3 . 16) = 92 g/mol
Já o volume da solução é encontrado por meio da fórmula da densidade:
d = m / v ? v = m / d
A massa da solução (m) é dada pela soma da massa do soluto (glicerina) com a do solvente (água):
m = 368 g + 1600 g = 1968 g
Assim, substituindo os dados na fórmula acima, para encontrar o valor do volume, temos:
V = 1968 g / 1,044g/cm³ = 1885 cm³
Na fórmula da concentração em mol/L, o volume tem que ser dado em L, por isso fazemos a seguinte transformação:
1 L = 1dm3
1cm³ = 0,001dm³
Se dm³ = L, então:
1 cm³ --------- 0,001 L
1885 cm³ ----- V (L)
1885 cm³ ----- V (L)
V = 1,885 L
Finalmente, podemos substituir todos os valores na fórmula da concentração em mol/L e encontrá-la:
M = __m1__
M1 . V(L)
M1 . V(L)
M = ________368 g______
(92 g/mol) . (1,885 L)
(92 g/mol) . (1,885 L)
M = 2,1 mol/L
Resolução:
- Dados do exercício:
m1 = ? (é o que se quer encontrar)
M1= 98 g/mol
V (L) = 2 L
M = 3 mol/L
Aplicando os dados na fórmula da concentração em mol/L, temos:
M = __m1__
M1 . V(L)
M1 . V(L)
m1 = M . M1 . V(L)
m1 = 3 mol/L . 98 g/mol . 2 L
m1 = 588 g
4) Qual será a concentração em quantidade de matéria de uma solução que foi preparada dissolvendo-se 120 g de hidróxido de sódio em 2 L de água e obteve-se uma solução com 2 L??
Resolução:
Dados:
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol
? Substituindo os valores dados na fórmula:
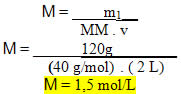
5) 10,00 mL de uma solução de (NH4)2SO4 foram tratados com excesso de NaOH. O gás NH3 liberado foi absorvido em 50,00 mL de uma solução 0,10 mol.L-1 de HC?. O HC? que sobrou foi neutralizado por 21,50 mL de uma solução 0,10 mol.L-1 de NaOH. Qual a concentração da solução de (NH4)2SO4 em mol.L-1?
a) 0,28
b) 0,14
c) 0,32
d) 0,42
e) 0,50
6) (PUC-RIO 2008) É possível conhecer a concentração de uma espécie iônica em solução aquosa, a partir do conhecimento da concentração de soluto e se o soluto dissolvido dissocia-se ou ioniza-se por completo. Uma solução de sulfato de sódio, Na2SO4 possui concentração em quantidade de matéria igual 0,3 mol L?1. Nessa solução, a concentração, em quantidade de matéria, da espécie Na+ é:
a) 0,2 mol L-1
b) 0,3 mol L-1
c) 0,6 mol L-1
d) 0,8 mol L-1
e) 0,9 mol L-1
7) Uma solução de ácido clorídrico a 10% em massa tem densidade 1,05 g/mL.Qual a concentração dessa solução em g/L ? C=105 g/l
8) Que volume de uma solução 0,778 mol/L Na2CO3 deveria ser diluído até 150 mL com água para reduzir sua concentração a 0,234 mol/L? v= 4,51 mL
- Exercícios Resolvidos Calorimetria
Calor(1) Para derreter uma barra de um material w de 1kg é necessário aquecê-lo até a temperatura de 1000°C. Sendo a temperatura do ambiente no momento analisado 20°C e o calor específico dew=4,3J/kg.°C, qual a quantidade de calor necessária...
- Questões Resolvidas De Vestibulares Sobre Hidrostática
Questões resolvidas de vestibular sobre Hidrostática - massa específica, densidade, pressão, pressão atmosférica e empuxo 1) (FCC 2005) Para responder as questões de números I e II considere uma piscina com as seguintes dimensões: comprimento:...
- Fazer Xixi No Mar é Melhor Do Que Se Pensa
Fim-de-semana de verão. Parece que todo o país foi para a praia. O areal está cheio e nada melhor do que um mergulho no mar para refrescar ideias e impedir o cérebro de derreter. A água entorpece os sentidos e a bexiga 'aperta'. Em princípio,...
- área Do Quadrado Questões Vestibular
Para calcular a área de um quadrado, basta elevar ao quadrado a medida de um lado, ou seja, S = L²Exemplo: O lado de um quadrado mede 6 cm. calcule sua área.S = L²S= 6²S= 36 cm Quando dispomos da medida das diagonais do quadrado,...
- área Do Quadrado Questões Vestibular
Artigo sobre área do quadrado com questões de fixação. Para calcular a área de um quadrado, basta elevar ao quadrado a medida de um lado, ou seja, S = L²Exemplo: O lado de um quadrado mede 6 cm. calcule sua área.S = L²S= 6²S=...
