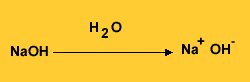Vestibular

O íon HPO42- é a base conjugada do íon H2PO4-.
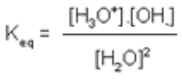
Se o elemento possuir somente uma valência, usamos a expressão ?hidróxido de? seguida do nome do elemento. Exemplo :
18) Numa série de ácidos, chamamos de mais forte aquele que:
a) reage mais rapidamente com metais.
b) tem maior constante de dissociação.
c) tem menor constante de dissociação.
d) consome menos moles de NaOH por mol de ácido na reação de neutralização.
e) consome mais moles e NaOH por mol de ácido na reação de neutralização.
19) Dadas as substâncias NaHCBaCO3, H3C-COOH, BF3; HCgO e Cu, é correto afirmar que:
a) NaHCBaCO3 é um sal de solução básica.
b) H3C-COOH é uma base de Arrhenius, pois libera OH em água.
c) BF3 é uma base de Bronsted-LowrY2O3, pois o boro tem par eletrônico disponível.
d) HCgO é uma base cuja nomenclatura é hidróxido de cloro.
e) Cu reage com HCg diluído produzindo um sal de solução básica.
Bases de Brönsted: H2O e CN-
ácido1 base1 ácido2 base2
1° par conjugado: HF e F-
2° par conjugado: H2O e H3O
15) a) Ácido nítrico
b) Ácido hipofosforoso
c) Ácido sulfúrico
d) Ácido fluorídrico
e) Ácido ortosilicico
3. ácido perclórico
4. ácido sulfuroso
5. ácido pirofosfórico
6. ácido clórico
7. ácido nitroso
8. ácido fosforoso

- Diferença Entre Dissociação Iônica E Ionização
Na água, os compostos iônicos sofrem dissociação, e os moleculares sofrem ionização Se colocarmos cloreto de sódio, o sal de cozinha (NaCl), em um recipiente contendo água, o que ocorrerá é que os íons já existentes no retículo cristalino...
- Indicadores ácido-base
Uso de papel de tornassol como indicador ácido-base Desde a Antiguidade já existia a necessidade de se identificar se os compostos eram ácidos ou básicos. Além disso, as soluções ácidas apresentam diferentes níveis de acidez, assim como as...
- Reações Químicas - Resumo (com Questões)
Reações químicas - conceito As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação...
- Sais E óxidos - Resumo (com Questões)
Função sal A função sal é caracterizada por compostos iônicos que apresentam, ao menos, um cátion diferente de H+ e, no mínimo, um ânion diferente de (OH)-. Exemplos: o sal de cozinha (NaCl), o mármore (CaCO3), o gesso (CaSO4), entre outras...
- ácidos Nucleicos Questões Vestibular
DNA e RNA Os ácidos nucleicos são macromoléculas encontradas em todas as células vivas, que constituem os genes, responsáveis pelo armazenamento, transmissão e tradução das informações genéticas. Tais moléculas recebem esse nome devido ao...
Vestibular
ácidos e bases - resumo (com questões)
Substâncias inorgânicas
Ácidos e bases (também chamadas de álcalis) são costumeiramente lembrados como substâncias químicas perigosas, corrosivos capazes de dissolver metais como se fossem comprimidos efervescentes. Mas a presença dos ácidos e base na nossa vida cotidiana é bem mais ampla e menos agressiva do que se imagina.
Eles também são componentes usuais de refrigerantes, alimentos, remédios, produtos de higiene ou cosméticos. São ainda matérias primas indispensáveis em um vasto universo de aplicações industriais. A tal ponto que a produção de ácido sulfúrico e soda cáustica de um país chega a ser considerada um dos indicadores do seu nível de atividade econômica.
Definições de ácidos e bases
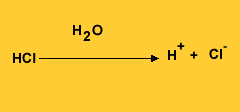
A definição mais tradicional dos ácidos e bases foi dada pelo cientista sueco Svante Arrhenius, que estabeleceu os ácidos como substâncias que - em solução aquosa - liberam íons positivos de hidrogênio (H+), enquanto as bases, também em solução aquosa, liberam hidroxilas, íons negativos OH-.
Assim, quando diluído em água, o cloreto de hidrogênio (HCl) ioniza-se e define-se como ácido clorídrico, como segue:
Já o hidróxido de sódio, a popular soda cáustica, ao se ionizar em água, libera uma hidroxila OH-, definindo-se assim como base:
Um desdobramento da definição de Arrhenius é a regra de reação para ácidos e bases entre si, segundo a qual:
Se reagirmos os já citados ácido clorídrico e soda cáustica, teremos:
Sendo o NaCl, o cloreto de sódio, o nosso velho conhecido sal de cozinha.
Outras definições de ácidos e bases
Uma outra definição para ácidos e bases foi dada pelo dinamarquês Johannes N. Bronsted e pelo inglês Thomas Lowry, independentemente, ficando conhecida como definição protônica. Segundo os dois, ácido é uma substância capaz de ceder um próton a uma reação, enquanto base é uma substância capaz de receber um próton.
A definição de Bronsted-Lowry é mais abrangente que a de Arrhenius, principalmente pelo fato de nem todas as substâncias que se comportam como bases liberarem uma hidroxila OH-, como é o caso da amônia (NH3). Além disso, a definição protônica não condiciona a definição de ácidos e básicos à dissolução em meio aquoso, como propunha a do químico sueco.
Bronsted e Lowry definiram ácidos e bases a partir dos prótons que liberavam e recebiam. Já o norte-americano Gilbert Newton Lewis em 1923, apresentou uma definição eletrônica de ácido e base, ele se baseou no conceito de base de Bronsted, que é a espécie que recebe próton, assim para receber próton, a base deve fornecer um par de elétrons para a ligação.
Ácido: toda espécie química que recebe par de elétrons.
Base: toda espécie química que doa par de elétrons.
Exemplo:
Ácido: toda espécie química que recebe par de elétrons.
Base: toda espécie química que doa par de elétrons.
Exemplo:
:NH3 | + | HOH |  | [ H3N:H ] + | + | OH ? |
base | ácido NH 4+ |
O NH3 é uma base porque recebeu um próton H+ da água.
A água é um ácido porque cedeu um próton ao NH3.
Pares Conjugados
Como vimos, a noção de ácidos e bases de Bronsted envolve, sempre, a transferência de um próton - do ácido para a base. Isto é, para um ácido desempenhar seu caráter ácido, ele deve estar em contato com uma base.
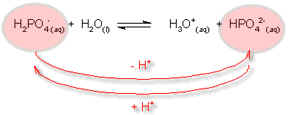
Por exemplo: o íon bicarbonato pode transferir um próton para a água, gerando o íon carbonato.


O íon HPO42- é a base conjugada do íon H2PO4-.
Como a reação é reversível, o íon carboxilato pode atuar como uma base, aceitando, na reação inversa, um próton do íon hidrônio - que atua como um ácido. Portanto, os íons bicarbonato e carbonato estão relacionados entre si, pela doação ou ganho de um próton, assim como a água e o íon hidrônio. Um par de substâncias que diferem pela presença de um próton é chamado de par ácido-base conjugado.
Desta forma, o íon carbonato é a base conjugada do ácido bicarbonato, e o íon hidrônio é o ácido conjugado da base H2O.
Força Relativa
Em água, alguns ácidos são melhores doadores de prótons do que outros, enquanto que algumas bases são melhores aceptoras de prótons do que outras.
Por exemplo: uma solução aquosa de HCl diluída consite, praticamente, de íons cloreto e hidrônio, uma vez que quase 100% das moléculas do ácido são ionizadas. Por isso, este composto é considerado um ácido de Bronsted forte.
Em contraste, uma solução diluída de ácido acético contém apenas uma pequena quantidade de íons acetato e hidrônio - a maior parte das moléculas permanece na forma não ionizada. Este composto é, portanto, considerado um ácido Bronsted fraco.
De acordo com o modelo de Bronsted, um ácido doa um próton para produzir uma base conjugada. Entretanto, esta base conjugada pode vir a aceitar o próton de volta, retornando ao ácido conjugado. A espécie capaz de se ligar mais fortemente ao próton é que vai determinar a força do ácido ou da base.
Portanto,
a) quanto mais forte for o ácido, mais fraca é a base conjugadaNeste caso, a ligação H-A é bastante fraca, e o íon A- é estável, ou seja, é uma base fraca.b) quanto mais fraco for o ácido, mais forte é a base conjugada.
Isto significa que a ligação H-A é uma ligação forte, pois o íon A- é pouco estável e representa uma base forte, que tende a recapturar o próton.
Kw, Ka e Kb
A constante de ionização da água, Kw
Como vimos anteriormente, a água sofre um processo de auto-ionização, produzindo íons hidrônios e hidróxidos.

Entretano, como o íon hidróxido é uma base muito mais forte do que a água, da mesma forma que o íon hidrônio é um ácido muito mais forte, o equlíbrio é grandemente deslocado para o lado esquerdo da equação. De fato, a 25oC, apenas 2 de cada um bilhão de moléculas sofrem auto-ionização.
Quantitativamente, podemos descrever o processo como:
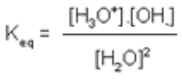
Todavia, em água pura ou em uma solução aquosa diluída, o termo [H2O] é uma constante (55,5 mol/L).
Desta forma, podemos simplificar a equação acima como:
Keq.[H2O]2 = Kw e
Kw = constante de ionização da água = [H3O+].[OH-]
a 25oC, Kw = 1,008 x 10-14 M2
Esta expressão de Kw é muito importante, e deve ser memorizada, pois é através dela que todos os conceitos de pH e pOH são deduzidos.
Identificação dos ácidos e bases
A escala de pH
Os ácidos possuem sabor azedo, como o encontrado nas frutas cítricas ricas no ácido de mesmo nome. Já as base tem gosto semelhante ao do sabão (sabor adstringente). Mas, felizmente, há modos mais eficazes e seguros de identificar ácidos e bases do que o paladar.
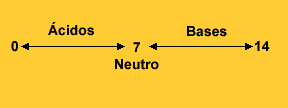
É possível medir a concentração de hidrogênio iônico em uma solução a partir de uma escala logarítmica inversa, que recebeu o nome de potencial hidrogeniônico, ou simplesmente, escala de pH.
Esta escala vai de zero a 14, sendo o pH 7 considerado neutro. Os valores menores que sete classificam a solução medida como ácida e os maiores que sete, como alcalinos (bases).
Escala de pH:
Para se medir o pH, usam-se combinações de substâncias indicadoras, como a fenolftaleína, que mudam de cor conforme a posição da substância testada na escala acima.
Também são usados instrumentos como os medidores de pH por eletrodo indicador, que mede as diferenças de potencial elétrico produzidas pelas concentrações de hidrogênio e indica o resultado dentro da escala de 0 a 14.
Nomenclatura dos ácidos
Para ácidos não oxigenados, usamos a terminação IDRICO. Exemplo:
- HCl ? ácido clorídrico
- H2S ? ácido sulfídrico
- H2Se ? ácido selenídrico
Para ácidos oxigenados, a coisa complica um pouco.
Se o elemento possuir somente uma valência, usamos a terminação ICO. Exemplo :
- H2CO3 ? ácido carbônico
- H3BO3 ? ácido bórico
Se o elemento tiver 2 valências, para a maior usamos ICO e para a menor OSO. Exemplos :
- H2SO3 ? ácido sulfuroso
- H2SO4 ? ácido sulfúrico
- HNO2 ? ácido nitroso
- HNO3 ? ácido nítrico
Se o elemento tiver 3 ou mais valências, usamos o prefixo HIPO junto com o sufixo OSO, e o prefixo PER junto com o sufixo ICO, nesta ordem.Exemplos :
- HClO ? ácido hipocloroso
- HClO2 ? ácido cloroso
- HClO3 ? ácido clórico
- HClO4 ? ácido perclórico
Existem casos em que o elemento forma diversos ácidos, porém sempre com a mesma valência.Usamos então os prefixos ORTO, META e PIRO. Exemplos :
- H3PO4 ? ácido ortofosfórico
- HPO3 ? ácido metafosfórico
- H4P2O7 ? ácido pirofosfórico
Note que nos três ácidos o fósforo tem valência +5.
Nomenclatura das bases
- NaOH ? hidróxido de sódio
- Ca(OH)2 ? hidróxido de cálcio
- Fe(OH)2 ? hidróxido ferroso ou hidróxido de ferro II
- Fe(OH)3 ? hidróxido férrico ou hidróxido de ferro III
Exercícios sobre ácidos e bases
1) Um próton pode ser representado por:
a) H0
b) H-
c) e+
d) e-
e) H+.
2) (PUC) Segundo Brönsted-Lowry, um ácido é uma base conjugada, diferem entre si por:
a) um próton
b) uma hidroxilia
c) um hidroxônio
d) um par de elétrons
e) uma ligação covalente.
3) (ITA) ?Ácido é uma substância capaz de receber 1 par de elétrons?.
A definição acima corresponde à proposta de:
a) Arrhenius
b) Brönsted
c) Lavoisier
d) Lewis
e) Ostwald
4) Ag+ é um ácido:
a) de Arrhenius
b) de Brönsted
c) de Lewis
d) nas três teorias
e) Ag+ não é um ácido.
5) (PUC) Um ácido de Lewis deve ter:
a) hidrogênio ionizável
b) oxigênio em sua molécula
c) baixa densidade eletrônica
d) larga densidade eletrônica
e) caráter iônico.
6) Escrever a equação da reação que ocorre quando se dissolve cianeto de hidrogênio em água. Indicar quais espécies químicas são ácidos de Brönsted e quais são bases de Brönsted.
7) No processo: HF + H2O - H3O+ + F-, determine os pares conjugados de acordo com a teoria de Brönsted-Lowry:
8) . Sabe-se que em água, alguns ácidos são melhores doadores de prótons que outros e algumas bases são melhores receptoras de prótons que outras. Segundo Bronsted, por exemplo, o HCO é um bom doador de prótons e considerado um ácido forte.
De acordo com Bronsted, pode-se afirmar
a) Quanto mais forte a base, mais forte é seu ácido conjugado.
b) Quanto mais forte o ácido, mais fraca é sua base conjugada.
c) Quanto mais fraco o ácido, mais fraca é sua base conjugada.
d) Quanto mais forte a base mais fraca é sua base conjugada.
e) Quanto mais forte o ácido mais fraco é seu ácido conjugado.
9) Os óxidos metálicos e não-metálicos reagem com água, ácidos e bases. Quando da reação com água fornecem ácidos ou bases, de acordo com sua classificação.
Assim, qual dos óxidos a seguir, quando em reação com este solvente, fornece o ácido mais forte?
a) SiO?
b) CO?
c) Na?O
d) SO3
e) MgO
10) Considere os cinco conjuntos de pares de moléculas no estado gasoso:
I - H?NNH? e CH?NH? II - N? e NH? III - CØ? e H?CCØ?
IV - N? e CO V - CCØ? e CH?
Qual das opções a seguir contém os conjuntos de pares de moléculas que são respectivamente: básicas, isoeletrônicas e apolares?
a) I, II e III
b) I, III e IV
c) II, IV e V
d) II, III e V
e) I, IV e V
11) (UFF 2008) Os alquimistas foram muito importantes para a química, a ciência da transformação. Tentando encontrar a pedra filosofal, que teria o poder de transformar qualquer metal em ouro, e o elixir da longa vida, que tornaria o ser humano imortal, criaram um grande número de aparelhos de laboratório e desenvolveram processos importantes para a produção de metais, de papiros, de sabões e de muitas substâncias, como o ácido nítrico, o ácido sulfúrico, o hidróxido de sódio e o hidróxido de potássio. Sobre essas substâncias, ácidos e bases, pode-se afirmar que:
a) as fórmulas do ácido nítrico e do ácido sulfúrico são HONO3 e H2SO4, respectivamente;
b) a reação entre ácido nítrico e o ácido sulfúrico conduz à produção de apenas um sal;
c) o hidróxido de sódio não reage com o ácido nítrico, pois se trata de uma base forte;
d) na reação entre ácido sulfúrico e o hidróxido de sódio podem ser formados dois sais;
e) a reação entre o ácido nítrico e o hidróxido de potássio pode conduzir à formação de dois sais: o Cu(NO3)2 e o Na2NO3.
12) Escreva as fórmulas das bases a seguir:
a) Hidróxido de lítio
b) Hidróxido de potássio
c) Hidróxido de estrôncio
d) Hidróxido de bário
e) Hidróxido de ferro II
f) Hidróxido de ferro III
g) Hidróxido cuproso
h) Hidróxido de cobre II
i) Hidróxido de cobre I
j) Hidróxido cúprico
k) Hidróxido de amôniol
l) Hidróxido férrico
m) Hidróxido ferroso
n) Hidróxido plúmbico
o) Hidróxido plumboso
p) Hidróxido de chumbo IV
q) Hidróxido de chumbo II
13) As bases, segundo a teoria de Arrhenius, são aquelas substâncias que, em solução aquosa, sofrem dissociação iônica, liberando como único ânion a hidroxila (OH-). Considerando que o OH é obrigatório na composição de toda base, elas também são chamadas de hidróxidos. Com base nisso, dê a nomenclatura das seguintes bases:
a) KOH
b) CsOH
c) Ba(OH)2
d) Sr(OH)2
e) Fe(OH)2
f) Fe(OH)3
g) Pb(OH)4
h) NH4OH
14) Dados os seguintes cátions (Hg+2, Li+, Ag+, Fe+2, Pt+4 e Sn+2), forneça as fórmulas de suas bases e seus respectivos nomes.
15) Dê os nomes respectivos dos seguintes ácidos:
a) HNO3
b) H3PO2
c) H2SO4
d) HF
e) H4SiO4
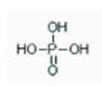
16) (UFV-MG) Observe a seguinte estrutura química:

O nome do composto representado acima é:
a) peróxido de fósforo
b) hidrácido fosforoso
c) hidróxido de fósforo
d) óxido hidrofosfórico
e) ácido fosfórico.
17) Forneça a nomenclatura para os ácidos:
1. HClO2
2. H3PO4
3. HClO4
4. H2SO3
5. H4P2O7
6. HClO3
7. HNO2
8. H3PO3
2. H3PO4
3. HClO4
4. H2SO3
5. H4P2O7
6. HClO3
7. HNO2
8. H3PO3
a) reage mais rapidamente com metais.
b) tem maior constante de dissociação.
c) tem menor constante de dissociação.
d) consome menos moles de NaOH por mol de ácido na reação de neutralização.
e) consome mais moles e NaOH por mol de ácido na reação de neutralização.
19) Dadas as substâncias NaHCBaCO3, H3C-COOH, BF3; HCgO e Cu, é correto afirmar que:
a) NaHCBaCO3 é um sal de solução básica.
b) H3C-COOH é uma base de Arrhenius, pois libera OH em água.
c) BF3 é uma base de Bronsted-LowrY2O3, pois o boro tem par eletrônico disponível.
d) HCgO é uma base cuja nomenclatura é hidróxido de cloro.
e) Cu reage com HCg diluído produzindo um sal de solução básica.
20) Nas reações representadas pelas equações:
I.(CBaCO3)2(aq) + 2H+(aq) ? CO2(g) + H2O(g)
II.NH3(g) + H2O(g) ? (NH4)+(aq) + OH(aq)
III.Cu2(aq) + 2OH(aq) ? Cu (OH)2(s)IV. (HSO4)(aq) + OH(aq) ? (SO4)2(aq) + H2O(g)
III.Cu2(aq) + 2OH(aq) ? Cu (OH)2(s)IV. (HSO4)(aq) + OH(aq) ? (SO4)2(aq) + H2O(g)
Há ácido de Arrhenius SOMENTE em:
a) I
a) 1-10, 2-6, 3-10, 4-7.
b) 1-9, 3-7, 3-9, 4-8.
c) 1-7, 2-8, 3-9, 4-7.
d) 1-7, 2-8, 3-9, 4-8.
e) 1-9, 2-6, 3-10, 4-7.
b) II
c) III
d) II e IV
e) III e IV.
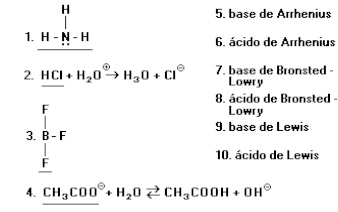
21) Considere as espécies sublinhadas contidas na coluna da esquerda com os conceitos enunciados na coluna da direita Assinale a opção que apresenta, apenas, associações corretas:
a) 1-10, 2-6, 3-10, 4-7.
b) 1-9, 3-7, 3-9, 4-8.
c) 1-7, 2-8, 3-9, 4-7.
d) 1-7, 2-8, 3-9, 4-8.
e) 1-9, 2-6, 3-10, 4-7.

22) A histamina é uma das substâncias responsáveis por reações alérgicas, como as que ocorrem ao se tocar em determinadas plantas. A sua fórmula é Sobre as suas características ácido-básicas, pode-se afirmar que se trata de
a) um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
b) uma base de Bronsted-LowrY2O3, pois o hidrogênio ligado ao nitrogênio 3 é ionizável.
c) uma base de Lewis, pois apresenta elétrons livres nos nitrogênios.
d) um ácido de Arrhenius, pois libera, em meio aquoso, os hidrogênios ligados aos átomos de carbono.
e) um ácido de Lewis, pois apresenta elétrons livres no nitrogênio 3.
a) um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
b) uma base de Bronsted-LowrY2O3, pois o hidrogênio ligado ao nitrogênio 3 é ionizável.
c) uma base de Lewis, pois apresenta elétrons livres nos nitrogênios.
d) um ácido de Arrhenius, pois libera, em meio aquoso, os hidrogênios ligados aos átomos de carbono.
e) um ácido de Lewis, pois apresenta elétrons livres no nitrogênio 3.
23) Assinale a alternativa que indica a espécie química que ao reagir com a água, pode funcionar como ácido de Bronsted.a) OH
b) O2
c) HCBaCO3
d) SO4-2
e) H
b) O2
c) HCBaCO3
d) SO4-2
e) H
24) Assinale, entre as alternativas abaixo, a fórmula de um composto que é uma Base de Lewis: a) CH4
b) C6H6
c) NH2CH2CH3
d) B Cg3
e) SiCg4
b) C6H6
c) NH2CH2CH3
d) B Cg3
e) SiCg4
25) Na reação: NH4 + + S2 ? NH3 + HS,o íon sulfeto (S2) é uma espécie de característica:a) básica, segundo a teoria de Bronsted - LowrY2O3.
b) básica, segundo a teoria de Arrhenius.
c) ácida, segundo a teoria de Lewis.
d) ácida, segundo a teoria de Bronsted-LowrY2O3.
e) ácida, segundo a teoria de Arrhenius.
b) básica, segundo a teoria de Arrhenius.
c) ácida, segundo a teoria de Lewis.
d) ácida, segundo a teoria de Bronsted-LowrY2O3.
e) ácida, segundo a teoria de Arrhenius.
26) Sabe-se que em água, alguns ácidos são melhores doadores de prótons que outros e algumas bases são melhores receptoras de prótons que outras. Segundo Bronsted, por exemplo, o HCg é um bom doador de prótons e considerado um ácido forte. De acordo com Bronsted, pode-se afirmar:
Gabarito:
a) Quanto mais forte a base, mais forte é seu ácido conjugado.
b) Quanto mais forte o ácido, mais fraca é sua base conjugada.
c) Quanto mais fraco o ácido, mais fraca é sua base conjugada.
d) Quanto mais forte a base mais fraca é sua base conjugada.
e) Quanto mais forte o ácido mais fraco é seu ácido conjugado.
Gabarito:
1) E 2) A 3) D 4) C 5) C 6) Seja a reação de ionização do HCN: HCN + H2O DH3O+ + CN-
Ácidos de Brönsted: HCN e H3O+Bases de Brönsted: H2O e CN-
7) próton
HF + H2O ¾¾ - H3O+ + F-ácido1 base1 ácido2 base2
1° par conjugado: HF e F-
2° par conjugado: H2O e H3O
8) B 9) D 10) E 11) D
12)
- LiOH
- KOH
- Sr(OH)2
- Ba(OH)2
- Fe(OH)2
- Fe(OH)3
- CuOH
- Cu(OH)2
- CuOH
- Cu(OH)2
- NH4OH
- Fe(OH)3
- Fe(OH)2
- Pb(OH)4
- Pb(OH)2
- Pb(OH)4
- Pb(OH)2
13) a) KOH: Hidróxido de potássio
b) CsOH: Hidróxido de césio
c) Ba(OH)2: Hidróxido de bário
d) Sr(OH)2 : Hidróxido de estrôncio
e) Fe(OH)2: Hidróxido de ferro II ou hidróxido ferroso
f) Fe(OH)3: Hidróxido de ferro III ou hidróxido férrico
g) Pb(OH)4: Hidróxido de chumbo IV ou plúmbico
h) NH4OH: Hidróxido de amônio
14) Hg(OH)2: Hidróxido mercúrico ou hidróxido de mercúrio II
LiOH: Hidróxido de lítio
AgOH: Hidróxido de prata
Fe(OH)2: Hidróxido de ferro II ou hidróxido ferroso
Pt(OH)4: Hidróxido platínico ou hidróxido de platina IV
Sn(OH)2: Hidróxido estanoso ou hidróxido de estanho II
b) Ácido hipofosforoso
c) Ácido sulfúrico
d) Ácido fluorídrico
e) Ácido ortosilicico
16) E
17) 1. ácido cloroso
2. ácido fosfórico3. ácido perclórico
4. ácido sulfuroso
5. ácido pirofosfórico
6. ácido clórico
7. ácido nitroso
8. ácido fosforoso
18) B 19) A 20) A 21) E 22) C 23) C 24) C 25) A 26) B
Fonte: http://educacao.uol.com.br/
http://brasilescola.com.br
Fonte: http://educacao.uol.com.br/
http://brasilescola.com.br

- Diferença Entre Dissociação Iônica E Ionização
Na água, os compostos iônicos sofrem dissociação, e os moleculares sofrem ionização Se colocarmos cloreto de sódio, o sal de cozinha (NaCl), em um recipiente contendo água, o que ocorrerá é que os íons já existentes no retículo cristalino...
- Indicadores ácido-base
Uso de papel de tornassol como indicador ácido-base Desde a Antiguidade já existia a necessidade de se identificar se os compostos eram ácidos ou básicos. Além disso, as soluções ácidas apresentam diferentes níveis de acidez, assim como as...
- Reações Químicas - Resumo (com Questões)
Reações químicas - conceito As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação...
- Sais E óxidos - Resumo (com Questões)
Função sal A função sal é caracterizada por compostos iônicos que apresentam, ao menos, um cátion diferente de H+ e, no mínimo, um ânion diferente de (OH)-. Exemplos: o sal de cozinha (NaCl), o mármore (CaCO3), o gesso (CaSO4), entre outras...
- ácidos Nucleicos Questões Vestibular
DNA e RNA Os ácidos nucleicos são macromoléculas encontradas em todas as células vivas, que constituem os genes, responsáveis pelo armazenamento, transmissão e tradução das informações genéticas. Tais moléculas recebem esse nome devido ao...