2 H2O2 ? 2 H2O + O2
Em primeiro lugar, devemos calcular a massa molar do peróxido de hidrogênio (H2O2):
MM = (1 * 2) + (2 * 16) = 2 + 32
MM = 34 g/mol
Com isso, temos que a a cada 2 minutos, perde-se uma massa de 3,4g de H2O2 (ou 0,1mol). Então, a cada minuto, perde-se 0,05mol de peróxido de hidrogênio.
De acordo com os coeficientes estequimétricos da reação, temos que, para cada molécula de O2 produzida, temos perda de duas moléculas de H2O2. Portanto, utilizemos a regra de três:
2mol de H2O2 ------------- 1mol de O2
0,05 mol de H2O2/mil -- x
x = 0,05/2
x = 0,025 mol de O2/min
Vestibular
 são
são e
e  . Determine o valor da constante de velocidade para essa reação, a 25ºC.
. Determine o valor da constante de velocidade para essa reação, a 25ºC.






 (aparente de 1ª ordem)
(aparente de 1ª ordem)





Logo, em t=20 min:


 atm
atm




Após + ½ hora, o tempo total será 1,5 h.














- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Exercícios Bioquímica
Aqui estão algumas questões de vestibulares sobre Bioquímica. Para conferir o gabarito selecione o texto no final de cada questão (Resposta: letra X). 1. (UNIR/RO) A mandioca, rica em amido, constitui o principal alimento energético de muitas famílias...
- Exercícios Resolvidos Estudo Dos Gases
Gases:1. Qual a velocidade média das moléculas de um gás que ocupa um recipiente de capacidade igual a 2 litros, tem massa igual a 20 gramas e pressão equivalente a 2 atmosféras?Lembrando que existe uma relação entre estas grandezas expressa por:...
- Questões E Resumo Sobre Energia Livre De Gibbs
Energia livre de GibbsEnergia livre de Gibbs é a energia de que o processo dispõe para realizar trabalho útil em temperatura e pressão constantes.Visto que em um processo a energia nunca é totalmente convertida em trabalho, a fração de energia...
- Equlibrio Químico - Questões Resolvidas De Vestibulares
Artigo sobre Equilíbrio químico com resumo e exercícios resolvidos de vestibulares. Equilíbrio químico é uma reação reversível na qual a velocidade da reação direta é igual à da reação inversa e, conseqüentemente, as concentrações...
Vestibular
Questões resolvidas de vestibular sobre Cinética Química
1) Os parâmetros de Arrhenius para a reação
 são
são e
e  . Determine o valor da constante de velocidade para essa reação, a 25ºC.
. Determine o valor da constante de velocidade para essa reação, a 25ºC.Solução:



2) A reação  é de primeira ordem em relação a cada reagente e ocorre em fase gasosa com uma constante de velocidade igual a
é de primeira ordem em relação a cada reagente e ocorre em fase gasosa com uma constante de velocidade igual a  . O composto B é um sólido volátil cuja pressão de vapor é de 0,1 atm na temperatura em que a reação ocorre. Calcule a pressão parcial dos componentes do sistema, 20 min depois de iniciada a reação, quando a mesma é realizada em um reator a volume constante, em presença de B sólido, partindo-se de A a uma pressão inicial de 5 atm.
. O composto B é um sólido volátil cuja pressão de vapor é de 0,1 atm na temperatura em que a reação ocorre. Calcule a pressão parcial dos componentes do sistema, 20 min depois de iniciada a reação, quando a mesma é realizada em um reator a volume constante, em presença de B sólido, partindo-se de A a uma pressão inicial de 5 atm.
 é de primeira ordem em relação a cada reagente e ocorre em fase gasosa com uma constante de velocidade igual a
é de primeira ordem em relação a cada reagente e ocorre em fase gasosa com uma constante de velocidade igual a  . O composto B é um sólido volátil cuja pressão de vapor é de 0,1 atm na temperatura em que a reação ocorre. Calcule a pressão parcial dos componentes do sistema, 20 min depois de iniciada a reação, quando a mesma é realizada em um reator a volume constante, em presença de B sólido, partindo-se de A a uma pressão inicial de 5 atm.
. O composto B é um sólido volátil cuja pressão de vapor é de 0,1 atm na temperatura em que a reação ocorre. Calcule a pressão parcial dos componentes do sistema, 20 min depois de iniciada a reação, quando a mesma é realizada em um reator a volume constante, em presença de B sólido, partindo-se de A a uma pressão inicial de 5 atm.Solução:
| t=0 |  |  |  |
| T |  |  |  |



 (aparente de 1ª ordem)
(aparente de 1ª ordem)




Logo, em t=20 min:


 atm
atm3) Para a reação de hidrogênio com iodo, a constante de velocidade vale  a 302°Ce
a 302°Ce  a 508°C.
a 508°C.
a) Calcule a energia de ativação e o fator de freqüência para esta reação.  a 302°Ce
a 302°Ce  a 508°C.
a 508°C. b) Qual é o valor da constante de velocidade a 400°C?
Solução:
a) Energia de ativação= 149,8 kJ; fator de freqüência=  (O fator de freqüência tem as mesmas unidades que a constante de velocidade)
(O fator de freqüência tem as mesmas unidades que a constante de velocidade)
b)
 (O fator de freqüência tem as mesmas unidades que a constante de velocidade)
(O fator de freqüência tem as mesmas unidades que a constante de velocidade)b)

4) A reação  é de ordem zero. Sabe-se que, em determinadas condições, operando em um reator a volume constante, após 1 hora do início da reação, 60% de A reagiu. Que quantidade de B será formada depois de mais ½ hora de reação?
é de ordem zero. Sabe-se que, em determinadas condições, operando em um reator a volume constante, após 1 hora do início da reação, 60% de A reagiu. Que quantidade de B será formada depois de mais ½ hora de reação?
 é de ordem zero. Sabe-se que, em determinadas condições, operando em um reator a volume constante, após 1 hora do início da reação, 60% de A reagiu. Que quantidade de B será formada depois de mais ½ hora de reação?
é de ordem zero. Sabe-se que, em determinadas condições, operando em um reator a volume constante, após 1 hora do início da reação, 60% de A reagiu. Que quantidade de B será formada depois de mais ½ hora de reação? Solução:




Após + ½ hora, o tempo total será 1,5 h.


A ? 2B | ||
t=0 |  | 0 |
t |  |  |





5) A hidrólise da sulfacetamida segue cinética de primeira ordem com constante de velocidade  , a 120° C. Calcular o tempo de meia-vida e a concentração que resta de sulfacetamida após 3 horas, considerando uma concentração inicial
, a 120° C. Calcular o tempo de meia-vida e a concentração que resta de sulfacetamida após 3 horas, considerando uma concentração inicial 
 , a 120° C. Calcular o tempo de meia-vida e a concentração que resta de sulfacetamida após 3 horas, considerando uma concentração inicial
, a 120° C. Calcular o tempo de meia-vida e a concentração que resta de sulfacetamida após 3 horas, considerando uma concentração inicial 
Solução:
quando a decomposição segue cinética de primeira ordem,

Para calcular a concentração após 3 horas , podemos usar:
, podemos usar:


6) Considere a reação genérica de primeira ordem . São introduzidos em um recipiente 20 mols de A e 4 mols de B. Verifica-se que após 10 min,
. São introduzidos em um recipiente 20 mols de A e 4 mols de B. Verifica-se que após 10 min,  . Determine a constante de velocidade da reação.
. Determine a constante de velocidade da reação.
Solução:

como estamos trabalhando a volume constante, podemos escrever:

e




nA é igual a nB quando XA=0,4

Para calcular a concentração após 3 horas
 , podemos usar:
, podemos usar:

6) Considere a reação genérica de primeira ordem
 . São introduzidos em um recipiente 20 mols de A e 4 mols de B. Verifica-se que após 10 min,
. São introduzidos em um recipiente 20 mols de A e 4 mols de B. Verifica-se que após 10 min,  . Determine a constante de velocidade da reação.
. Determine a constante de velocidade da reação.Solução:

como estamos trabalhando a volume constante, podemos escrever:

e


O termo  é a quantidade do B formada a partir do reagente A.
é a quantidade do B formada a partir do reagente A.
Após 10 min, e
e 
 é a quantidade do B formada a partir do reagente A.
é a quantidade do B formada a partir do reagente A.Após 10 min,
 e
e 



nA é igual a nB quando XA=0,4

7) Uma substância gasosa se decompõe termicamente de acordo com a equação:

A variação da pressão parcial (que é proporcional à concentração) do reagente  , a
, a  , em diferentes tempos de reação, está indicada na tabela abaixo, quando se parte de
, em diferentes tempos de reação, está indicada na tabela abaixo, quando se parte de  puro:
puro:
 , a
, a  , em diferentes tempos de reação, está indicada na tabela abaixo, quando se parte de
, em diferentes tempos de reação, está indicada na tabela abaixo, quando se parte de  puro:
puro:Tempo (h) | 0 | 5 | 15 | 35 |
Pressão de  (mmHg) (mmHg) | 660 | 330 | 165 | 82,5 |
Considerando que a decomposição é irreversível, determine a ordem da reação e calcule a constante de velocidade para essa reação.
Solução:
Método das tentativas:
Ordem zero:







Concluímos que a reação não é de ordem zero, pois o valor de k não é uma constante.
1ª ordem






1ª ordem






O valor de k não resultou em uma constante, portanto, não é de 1ª ordem.
2ª Ordem











O valor de k ficou constante, então a reação é de segunda ordem, com constante de velocidade  .
.
 .
.8) (UERJ) A sabedoria popular indica que, para acender uma lareira, devemos utilizar inicialmente lascas de lenha e só depois colocarmos as toras.
Em condições reacionais idênticas e utilizando massas iguais de madeira em lascas e em toras, verifica-se que madeira em lascas queima com mais velocidade.
O fator determinante, para essa maior velocidade da reação, é o aumento da:
a) pressão
b) temperatura
c) concentração
d) superfície de contato
Em condições reacionais idênticas e utilizando massas iguais de madeira em lascas e em toras, verifica-se que madeira em lascas queima com mais velocidade.
O fator determinante, para essa maior velocidade da reação, é o aumento da:
a) pressão
b) temperatura
c) concentração
d) superfície de contato
9) Realizou-se a reação de decomposição do ácido carbônico: H2CO3 à H2O + CO2. Mediu a concentração em quantidade de matéria de gás carbônico nos tempos 10s e 20s e obteve o seguinte resultado em mol/L:
10s : 0,2 M
20s : 0,8 M
Qual a velocidade média dessa reação no intervalo de 10s a 20s?
10) (Unicamp-SP) Amostras de magnésio foram colocadas em soluções de ácido clorídrico a diversas concentrações e temperaturas havendo total "dissolução" do metal e desprendimento de gás hidrogênio . Observaram-se os seguintes resultados:
a) Em qual caso a velocidade média da reação foi maior?
b) Em qual caso desprendeu-se maior quantidade de hidrogênio?
11) (PUC-MG) Considere a equação: 2NO2 + 4CO à N2 + 4CO2. Admita que a formação do gás nitrogênio tem uma velocidade média constante igual a 0,05 mol/L.min. Qual a massa, em gramas, de gás carbônico formada em uma hora?
12) (Fuvest-SP) Para uma dada reação química, expressa como A à B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
01. O catalisador afeta a velocidade de uma reação porque aumenta o número de moléculas com energia cinética maior ou igual à energia de ativação da reação.
19) (SANTA CASA) A reação hipotética 2X + 2Y ® P + Q poderá ocorrer segundo o seguinte mecanismo:
X + Y ® Z + W .............................. V1
X + Z ® P ...................................... V2
W + Y ® Q .................................... V3
(soma): 2X + 2Y ® P + Q .......................... V4
onde V são as velocidades das reações expressas em mol . l-1 . s-1.
Admitindo que V1 = V3 > V2, a velocidade global, V4, deverá ser mais próxima de:
a) V1 + V2
b) V2
c) V3
d) V3 ? V2
e) 2V1 + V2
10s : 0,2 M
20s : 0,8 M
Qual a velocidade média dessa reação no intervalo de 10s a 20s?
10) (Unicamp-SP) Amostras de magnésio foram colocadas em soluções de ácido clorídrico a diversas concentrações e temperaturas havendo total "dissolução" do metal e desprendimento de gás hidrogênio . Observaram-se os seguintes resultados:
Amostra | Massa de magnésio "dissolvida" | Tempo para dissolver |
I | 2,0g | 10 min |
II | 0,40g | 2,0 min |
III | 0,40g | 1,0 min |
IV | 0,50g | 1,0 min |
a) Em qual caso a velocidade média da reação foi maior?
b) Em qual caso desprendeu-se maior quantidade de hidrogênio?
11) (PUC-MG) Considere a equação: 2NO2 + 4CO à N2 + 4CO2. Admita que a formação do gás nitrogênio tem uma velocidade média constante igual a 0,05 mol/L.min. Qual a massa, em gramas, de gás carbônico formada em uma hora?
12) (Fuvest-SP) Para uma dada reação química, expressa como A à B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
13) (Mack-SP) Numa certa experiência, a síntese do cloreto de hidrogênio ocorre com o consumo de 3 mols de gás hidrogênio por minuto. Qual a velocidade de formação do cloreto de hidrogênio?
14) Na reação 2H2O2 à 2H2O + O2, a velocidade média dessa reação num certo intervalo de tempo, é 8 mol/s em relação a água oxigenada. Qual a velocidade em relação ao oxigênio no mesmo intervalo de tempo?
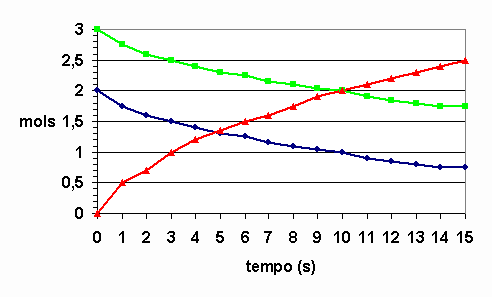
15) Foi misturado 2 mols de gás hidrogênio com 3 mols de gás cloro num recipiente fechado. Suponha que do início da mistura até 15s, a reação H2 + Cl2 à 2HCl ocorra conforme os dados da tabela.
Tempo (s) | Quantidade de matéria (em mols) de H2 existente | Quantidade de matéria (em mols) de Cl2 existente | Quantidade de matéria (em mols) de HCl existente |
0 | 2,0 | 3,0 | 0 |
1 | 1,75 | 2,75 | 0,5 |
3 | 1,5 | 2,5 | 1,0 |
6 | 1,25 | 2,25 | 1,5 |
10 | 1,0 | 2,0 | 2,0 |
15 | 0,75 | 1,75 | 2,5 |
16) (MAUÁ) Por que o catalisador altera velocidade de uma reação?
a) Calcule a velocidade em relação a cada participante e a velocidade média da reação no intervalo de 10 a 15s.
b) Usando papel milimetrado, construa no mesmo sistema de coordenadas o gráfico que mostra a variação da quantidade existente (em mol) de cada participante em função do tempo. Represente a quantidade em mol na ordenada e o tempo na abcissa.
17) (OSEC) Em uma reação, o complexo ativado:
a) possui mais energia que os reagentes ou os produtos.
b) age como catalisador.
c) sempre forma produtos.
d) é composto estável.
e) possui menos energia que os reagentes ou os produtos.
18) (UnB) Assinale as opções corretas:
01. O catalisador afeta a velocidade de uma reação porque aumenta o número de moléculas com energia cinética maior ou igual à energia de ativação da reação.
02. A temperatura afeta a velocidade de uma reação porque muda a energia de ativação da reação.
04. A concentração dos reagentes afeta a velocidade de uma reação porque há alteração no número de colisões efetivas.
08. Uma reação ocorre quando há colisão efetiva entre as moléculas reagentes, numa orientação apropriada.
X + Y ® Z + W .............................. V1
X + Z ® P ...................................... V2
W + Y ® Q .................................... V3
(soma): 2X + 2Y ® P + Q .......................... V4
onde V são as velocidades das reações expressas em mol . l-1 . s-1.
Admitindo que V1 = V3 > V2, a velocidade global, V4, deverá ser mais próxima de:
a) V1 + V2
b) V2
c) V3
d) V3 ? V2
e) 2V1 + V2
20) (FIT - MG) Em determinada experiência, a reação de formação de água está ocorrendo com o consumo de 4 mols de oxigênio por minuto. Conseqüentemente, a velocidade de consumo de hidrogênio é de:
25) (UFMT) "Nas madeiras, o pó de madeira (serragem) pode ser queimado por uma faísca ou chama, e produzir incêndios de proporções incalculáveis." Indique os fatores que tem influência na velocidade da reação que justifica essa afirmação. Justifique.
30) (E.E.Mauá-SP) A concentração [A], expressa em mol/L de uma substância A que, em meio homogêneo, reage com outra B, segundo a equação A + B à C + D, varia com o tempo t segundo a lei: [A]= 5 ? 0,2t ? 0,1t2, com t medido em horas. Qual a velocidade média dessa reação entre os instantes t1 = 1h e t2 = 2h?
Solução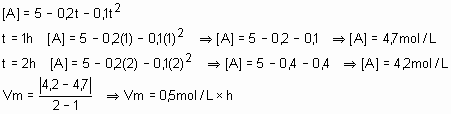
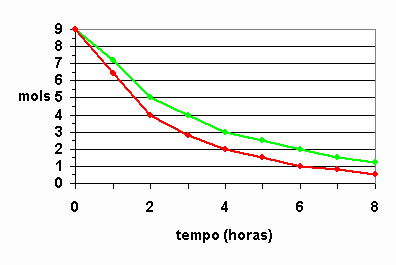
31) (UFC-CE) O tempo de validade de um alimento em suas características organolépticas e nutricionais depende da embalagem e das condições ambientais. Um dos tipos de acondicionamento necessário para a conservação de alimentos e a folha-de-flandres, constituída de uma liga de estanho e aço. Analise o gráfico abaixo, que representa a reação de oxidação entre a embalagem e o meio agressivo e responda:
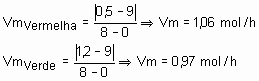
9) 0,06 M
10) a) V I= 0,2g/min; V Il= 0,2g/min; V lII= 0,4g/min; V IV=0,5g/min. A velocidade maior é 0,5g/min, ou seja, a amostra IV.
b)Quanto maior a massa de magnésio consumida, maior a quantidade de hidrogênio desprendida. Então, a amostra IV desprende mais hidrogênio.
11) 528 g
12) 90 min.
13) 6 mol/min.
14) 4 mol/s
15) a) V H2= 0,025; V Cl2= 0,025; V HCl= 0,05; Vm=0,025 mol/s
 16) Porque diminui a energia de ativação dos reagentes.
16) Porque diminui a energia de ativação dos reagentes.
17) A
18) 12
19) B
20) A
21) B
22) E
23) B
24) E
25) 1) Natureza dos reagentes = Em contato com o fogo a serragem facilmente reagirá.
2) Superfície de contato = A serragem possui mais superfícies que estão em contato com o fogo (em relação à madeira inteira).
a) 8 mols/minuto
b) 4 mols/minuto
c) 12 mols/minuto
d) 2 mols/minuto
e) n.d.a.
21) A amônia (NH3) é de grande importância na fabricação de fertilizantes. Ela pode ser obtida a partir de hidrogênio (H2) e nitrogênio (N2). A lei de velocidade para essa reação é V = k [ H2 ]3 [ N2 ].
Quando a concentração de hidrogênio é duplicada e a concentração de nitrogênio é triplicada, mantendo-se constante a temperatura, é correto afirmar que
(A) a velocidade final não é alterada.
(B) a velocidade final é 24 vezes a velocidade inicial.
(C) a velocidade final é 6 vezes a velocidade inicial.
(D)a velocidade final é 18 vezes a velocidade inicial.
(E) a velocidade final é 54 vezes a velocidade inicial.
22) Uma certa reação química é representada pela equação: 2A(g) + 2B(g) ® C(g) , onde ?A?, ?B? e ?C? significam as espécies químicas que são colocadas para reagir. Verificou-se experimentalmente, numa certa temperatura, que a velocidade desta reação quadruplica com a duplicação da concentração da espécie ?A?, mas não depende das concentrações das espécies ?B? e ?C?. Assinale a opção que contém, respectivamente, a expressão CORRETA da velocidade e o valor CORRETO da ordem da reação.
(A) v = k[A]2 [B]2 e 4
(B) v = k[A]2 [B]2 e 3
(C) v = k[A]2 [B]2 e 2
(D) v = k[A]2 e 4
(E) v = k[A]2 e 2
23) Duas substâncias gasosas A e B reagem em um recipiente fechado, de acordo com a seguinte lei de velocidade:
velocidade = k [A] . [B]2
Com relação a esta reação são feitas as seguintes afirmações:
I. Mantida constante a temperatura, a velocidade aumentará oito vezes, se o volume inicial for à metade.
II. Mantido constante o volume, uma diminuição de temperatura provoca uma diminuição na velocidade da reação.
III. Mantidos constantes o volume, a temperatura e a concentração de A, e diminuindo pela metade a concentração de B, a velocidade aumenta quatro vezes.
Podemos afirmar que:
(A) I, II e III são corretas.
(B) apenas I e II são corretas.
(C) apenas I e III são corretas.
(D) apenas II e III são corretas.
(E) apenas II é correta.
24) O estudo cinético, em fase gasosa, da reação representada por: NO2 + CO ® CO2 + NO,mostrou que a velocidade da reação não depende da concentração de CO, mas depende da concentração de NO2 elevada ao quadrado. Esse resultado permite afirmar que
(A) o CO atua como catalisador.
(B) o CO é desnecessário para a conversão de NO2 em NO
(C) o NO2 atua como catalisador.
(D)a reação deve ocorrer em mais de uma etapa.
(E) a velocidade da reação dobra se a concentração inicial de NO2 for duplicada.
25) (UFMT) "Nas madeiras, o pó de madeira (serragem) pode ser queimado por uma faísca ou chama, e produzir incêndios de proporções incalculáveis." Indique os fatores que tem influência na velocidade da reação que justifica essa afirmação. Justifique.
26) O que é cinética química?
27) O que é complexo ativado?
28) Por que o aumento da energia de ativação retarda a velocidade da reação química?
29) (FEI-SP) ? Seja a decomposição de H2O2->2H2O2 ->2H2O + O2. Em 2 minutos, observa-se uma perda de 3,4g de H2O2. Qual a velocidade média dessa reação em relação ao O2 em mol/min?
Dado: massa molar H = 1g/mol e O = 16g/mol
a) 0,250
b) 0,050
c) 0,0025
d) 0,500
e) 0,025
Solução:
Alternativa E
Solução
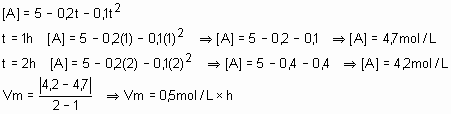
31) (UFC-CE) O tempo de validade de um alimento em suas características organolépticas e nutricionais depende da embalagem e das condições ambientais. Um dos tipos de acondicionamento necessário para a conservação de alimentos e a folha-de-flandres, constituída de uma liga de estanho e aço. Analise o gráfico abaixo, que representa a reação de oxidação entre a embalagem e o meio agressivo e responda:

a)Em qual das curvas, verde ou vermelha, a velocidade da reação química é mais acentuada?
Solução:
Curva vermelha, pois considerando que as duas saíram com o mesmo número de mols, ou seja, 9 mols e a vermelha terminou com uma quantidade menor que a verde. Daí, dá para calcular a velocidade média da reação global, que seria a vermelha maior que 1 e a verde, menor que 1. Para confirmar, basta jogar na fórmula da velocidade média. Veja só:
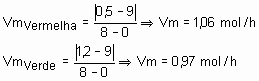
b)Considerando a área da folha-de-flandres constante, calcule a velocidade média da reação química no intervalo entre duas e 4 horas para a curva de maior corrosão.
Resposta: 1g/h
Gabarito:9) 0,06 M
10) a) V I= 0,2g/min; V Il= 0,2g/min; V lII= 0,4g/min; V IV=0,5g/min. A velocidade maior é 0,5g/min, ou seja, a amostra IV.
b)Quanto maior a massa de magnésio consumida, maior a quantidade de hidrogênio desprendida. Então, a amostra IV desprende mais hidrogênio.
11) 528 g
12) 90 min.
13) 6 mol/min.
14) 4 mol/s
15) a) V H2= 0,025; V Cl2= 0,025; V HCl= 0,05; Vm=0,025 mol/s
b)

17) A
18) 12
19) B
20) A
21) B
22) E
23) B
24) E
25) 1) Natureza dos reagentes = Em contato com o fogo a serragem facilmente reagirá.
2) Superfície de contato = A serragem possui mais superfícies que estão em contato com o fogo (em relação à madeira inteira).
26) É uma área da Química que estuda a velocidade das reações químicas e os fatores que alteram esta velocidade.
27) É a espécie química com maior valor energético em toda a reação química que tem vida curtíssima
28) Porque dificulta a barreira de energia, diminui a chance de colisões efetivas e assim diminui a velocidade da reação.
Velocidade de uma reação
Velocidade de uma reação: a rapidez com que os reagentes são consumidos ou a rapidez com que os produtos são formados.
O exemplo mais simples de uma reação é quando um único reagente se transforma em um único produto. Genericamente, temos: A ® B reagente produto
No instante inicial, a concentração ou a quantidade do reagente A é máxima e vai diminuindo com o decorrer do tempo. Já a concentração do produto B, no instante inicial, é igual a zero e vai aumentando com o decorrer do tempo. Normalmente, a concentração é indicada em molL-1(molaridade), sendo representada por um colchete ([]) contendo a fórmula da substância. Podemos representar, em gráficos separados ou em um único gráfico, as variações ocorridas na concentração dos participantes das reações em função do tempo:
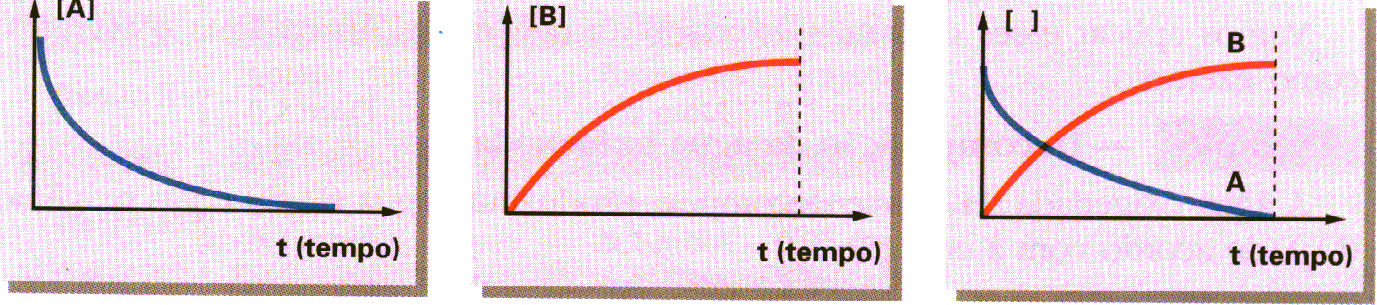
Observando os gráficos, verificamos que, no tempo t, o reagente A foi totalmente consumido; logo, a reação terminou. Nesse mesmo tempo t, a concentração do produto B formado é máxima.
DETERMINACÃO DA VELOCIDADE MÉDIA DE UMA REAÇAO
A velocidade média de uma reação química pode ser expressa pela razão entre a variação da concentração de um dos reagentes ou de um dos produtos e o intervalo de tempo no qual ocorreu essa variação:
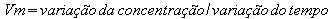
Além da molaridade, as variações das quantidades de reagentes e produtos podem ser expressas em massa, volume (gases), número de mols etc., enquanto o tempo pode ser expresso em hora, minuto e segundo. Quando a concentração de reagentes e produtos for expressa em molaridade, a expressão da velocidade média será dada por:
Vm = D[ ]/ D t
onde: D t = intervalo de tempo ocorre a varição da concentração, ou seja: D t = (tfinal ? tinicial) D [ ] = [final] ? [inicial]
Ao calcularmos o D [reagentes], notamos que ele apresenta um valor menor do que zero, ou seja, tem valor negativo, pois a concentração final é menor do que a inicial. Para evitarmos trabalhar com valores negativos, usamos -P[reagentes] na expressão da velocidade média dos reagentes. Logo, a velocidade média de consumo dos reagentes é calculada por:
Assim, a velocidade média pode ser expressa por: Vamos aplicar esses conceitos estudando a decomposição da água oxigenada, como exemplo.
Exemplo - Decomposição da água oxigenada. A água oxigenada (H202) se decompõe, produzindo água (H20) e gás oxigênio (O2), de acordo com a equação:
2 H2O2(aq) ® 2 H2O(1) + 1 02(g)
O gráfico a seguir foi construído a partir de dados obtidos num determinado experimento.
[H2O2]=mol/L 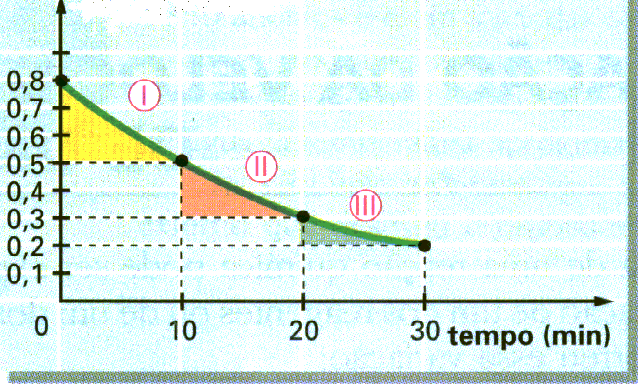
Aplicando a equação, temos:
Vm = - D [H2O2]/ D t
Vamos determinar a velocidade média nos três trechos:
I ? Vm = -(-0,3)/10 =0,03 mol/L.min
II ? Vm = -(-0,2)/10 =0,02 mol/L.min
III ? Vm = -(-0,1)/10 =0,01 mol/L.min
Analisando os valores das velocidades médias de consumo do H202, podemos perceber que elas não são constantes e que o seu valor máximo é encontrado no início da reação. Esse fato permite concluir que a velocidade média diminui de acordo com a diminuição da concentração. A partir desse gráfico também podemos construir outro, representando a formação dos produtos (H20 e 02). Para isso, devemos conhecer a proporção estequiométrica da reação:
2 H202(aq) ® 2 H20 + 02 proporção: 2 mols 2 mols 1 mol
Representação gráfica das concentrações molares do H20 e do 02 , em função do tempo.
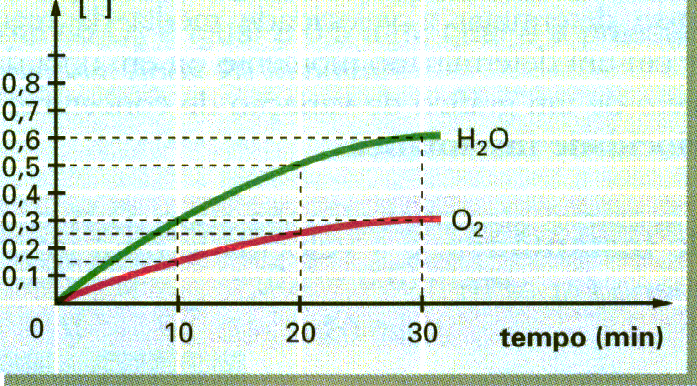
Podemos determinar, também, as velocidades médias de formação da água (H20 ) e do gás oxigênio (02) num determinado intervalo de tempo (0 10 mm).
Formação da H20: Vm = 0,3/10 Þ Vm H20 = 0,03 mol/L.min
Formação da O2: Vm = 0,15/10 Þ Vm O2 = 0,015 mol/L.min
Observando, então, as velocidades médias dos participantes da reação no intervalo de 0 a 10 min, temos os seguintes dados:
Vm de consumo de H2 O2: = 0,03 mol/L.min Vm de formação de H20: = 0,03 mol/L.min Vm de formação de O2: = 0,015 mol/L.min
Notamos que esses valores apresentam entre si uma proporção igual à proporção estequiométrica, isto é, 2 : 2: 1. Dividindo as velocidades médias encontradas pelos respectivos coeficientes estequiométricos, encontraremos sempre o mesmo valor, que será considerado o valor da velocidade média da reação:
Vm reação = (Vm H202 /2) = (Vm H20 /2) = (Vm O2 /2) = 0,015 mol/L.min
Genericamente, para a reação dada: aA + bB ® cC temos: Vm reação = (Vm A /a) = (Vm B /b) = (Vm C /c)
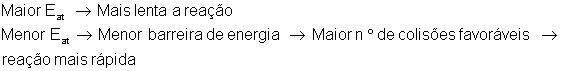


Fonte: http://luizclaudionovaes.sites.uol.com.br/enerat1.gif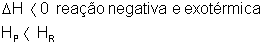
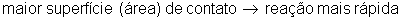


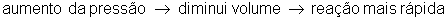

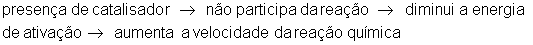
http://clientespeedy.klickeducacao.com.br/2006/arq_img_upload/paginas/558/cineticanew2.jpg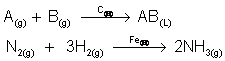
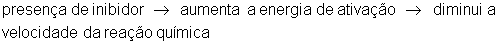
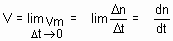
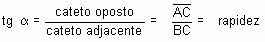
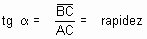
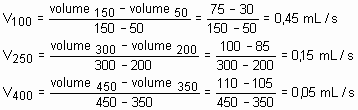
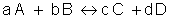
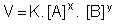
Onde:
V = velocidade da reação
K = constante de velocidade
[A] = concentração molar de A
[B] = concentração molar de B
X e Y = expoentes experimentalmente determinados
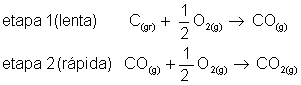
_____________________________________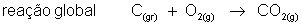
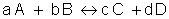
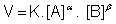
Fonte: http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/velocidade.html
27) É a espécie química com maior valor energético em toda a reação química que tem vida curtíssima
Cinética Química - resumo
É a parte da Química que faz o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições e quais os mecanismos de desenvolvimento de uma reação. Para isso devemos também criar outros conceitos que serão necessários no nosso estudo. Vejamos:
Velocidade de uma reação
Diferentes reações ocorrem com diferentes velocidades; em algumas, o consumo dos reagentes e a formação dos produtos são tão rápidos que a reação é praticamente instantânea.
Em outros casos, a reação pode demorar meses ou até anos para ocorrer. A fermentação do suco de uva, por exemplo, usado na produção de vinho, pode demorar meses para ser completada.

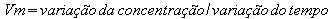
Vm dos reagentes = - D [reagentes]/ D t
Vm dos reagentes = - D [reagentes]/ D t ou
Vm dos produtos = D [produtos]/ D t


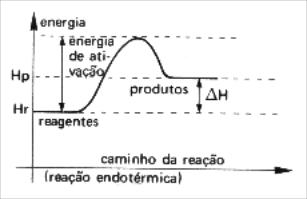
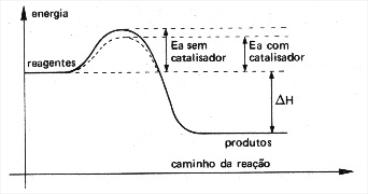
ENERGIA DE ATIVAÇÃO(Eat)
É a energia mínima que os reagentes precisam para que inicie a reação química. Esta energia mínima é necessária para a formação do complexo ativado.
Quanto maior a energia de ativação mais lenta é a reação porque aumenta a dificuldade para que o processo ocorra.
Quanto menor a energia de ativação menor a ?barreira? de energia, mais colisões efetivas e portanto uma reação mais rápida.
Quanto maior a energia de ativação mais lenta é a reação porque aumenta a dificuldade para que o processo ocorra.
Quanto menor a energia de ativação menor a ?barreira? de energia, mais colisões efetivas e portanto uma reação mais rápida.
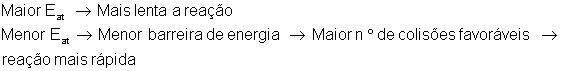
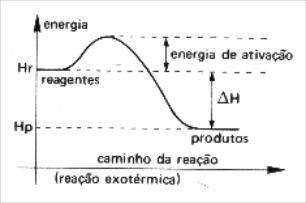
Gráficos Endotérmicos e Exotérmicos para a Energia de Ativação
A energia de ativação varia de acordo com o tipo de reação química. Nas reações endotérmicas ela é maior do que nas exotérmica.


Onde:


Endotérmico

Fonte: http://luizclaudionovaes.sites.uol.com.br/enerat1.gif
Exotérmico
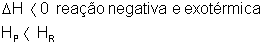

FATORES QUE ALTERAM A VELOCIDADE DAS REAÇÕES QUÍMICAS
Alguns fatores podem aumentar ou diminur a velocidade de uma reação química. São eles:
- temperatura
- superfície de contato
- pressão
- concentração
- presença de luz
- catalisador
- inibidores
- temperatura
- superfície de contato
- pressão
- concentração
- presença de luz
- catalisador
- inibidores
Temperatura
A temperatura está ligada à agitação das moléculas. Quanto mais calor, mais agitadas ficam as moléculas. Se aumenta a temperatura, aumenta a energia cinética das moléculas (movimento). Se as moléculas se movimentam mais, elas se chocam mais e com mais energia, diminuindo a energia de ativação e em consequência, aumenta o número de colisões efetivas e portanto a velocidade da reação também aumenta.
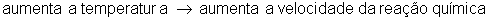
Por este motivo, aumentamos a chama do fogão para cozinhar e utilizamos a geladeira para evitar a deterioração dos alimentos.
Superfície de Contato
A área de contato entre os reagentes também interfere na velocidade das reações químicas. Quanto maior a superfície de contato, maior o número de moléculas reagindo, maior o número de colisões eficazes e portanto, aumenta a velocidade da reação.
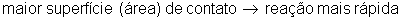
Isto explica porque devemos tomar um comprimido de aspirina, por exemplo, inteiro do que em pó. O comprimido em pó reage mais rapidamente, causando lesões no nosso estômago. Se ele for ingerido inteiro, levará mais tempo para reagir, evitando lesões.


Uma substância em pó reage mais rápido do que uma substância inteira porque possui maior superfície de contato.
Veja outros exemplos:
- a carne é digerida mais facilmente quando mastigada do que inteira;
- gravetos queimas mais rápido do que um pedaço de madeira de mesma massa;
- palha de aço queima mais rápido do que um pedaço de ferro de mesma massa.
- a carne é digerida mais facilmente quando mastigada do que inteira;
- gravetos queimas mais rápido do que um pedaço de madeira de mesma massa;
- palha de aço queima mais rápido do que um pedaço de ferro de mesma massa.
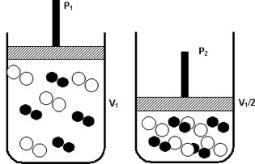
Pressão
Pressão é a razão entre força e área, ou seja, fazer força sobre uma determinada área. Com o aumento da pressão em um recipiente, diminui o volume e desta forma aumenta a concentração dos reagentes. As moléculas se chocam mais, aumentando o número de colísões e portanto, aumenta a velocidade da reação.
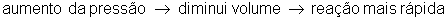

Concentração
Concentração está relacionado à quantidade de soluto e de solvente de uma substância. Se aumenta a concentração de reagentes , aumenta o número de moléculas dos reagentes, aumentando o número de colísões e aumentando também a velocidade da reação. Está associada à Lei Cinética (Lei de Guldber-Waage).
Quando se aumenta a concentração de oxigênio numa queima, a combustão acontece mais rápido.
Quando se aumenta a concentração de oxigênio numa queima, a combustão acontece mais rápido.

Presença de Luz
Algumas reações químicas ocorrem com maior velocidade quando estão na presença de luz. A luz influencia na velocidade das reações porque é uma energia em forma de onda eletromagnética que ajuda a quebrar a barreira da energia de ativação.
A água oxigenada, por exemplo, se decompõe mais facilmente quando está exposta à luz, por isso devemos deixá-la guardada em local escuro. A fotossíntese realizada pelas plantas é um tipo de reação que é influenciada pela presença da luz. Outra reação onde é muito utilizada a luz é a decomposição do AgBr que dá origem aos filmes fotográficos.
A água oxigenada, por exemplo, se decompõe mais facilmente quando está exposta à luz, por isso devemos deixá-la guardada em local escuro. A fotossíntese realizada pelas plantas é um tipo de reação que é influenciada pela presença da luz. Outra reação onde é muito utilizada a luz é a decomposição do AgBr que dá origem aos filmes fotográficos.
Catalisador
Catalisador é uma substância química que não participa da reação química. Diminui a energia de ativação e aumenta a velocidade da reação.
O catalisador acelera a reação mas não altera a composição química dos reagentes e produtos envolvidos. A quantidade de substância produzida na reação não se altera com o uso de catalisadores.
Se a reação for reversível, a reação inversa também será acelerada, pois sua energia de ativação também terá um valor menor.
O catalisador não altera a variação de entalpia.
Se a reação for reversível, a reação inversa também será acelerada, pois sua energia de ativação também terá um valor menor.
O catalisador não altera a variação de entalpia.
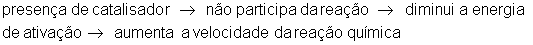
Gráficos com e sem catalisadores:

http://clientespeedy.klickeducacao.com.br/2006/arq_img_upload/paginas/558/cineticanew2.jpg
Catálise é o aumento de velocidade da reação, provocado pelo catalisador.
A palavra catálise, do grego katálysis, foi introduzida, em 1835, por Berzeliu.
A palavra catálise, do grego katálysis, foi introduzida, em 1835, por Berzeliu.
No nosso organismo existem muitos catalisadores, que são chamados de enzimas. A saliva e o suco gástrico (que contém ácido clorídrico) são exemplos de enzimas que aumentam a velocidade da reação, no caso, a digestão.
Nas indústrias químicas, principalmente a petroquímica, os catalisadores são muito utilizados para acelerar as reações, deixando o processo mais barato.
Uma forma de ver a ação dos catalisadores é adicionando açúcar ao refrigerante. Os refrigerenates carbonatados contém dióxido de carbono (gás carbônico) e pode ser eliminado mais facilmente com adição de açúcar. A reação de eliminação do gás acontece com mais velocidade e percebe-se a formação de bolhas do gás deixando a solução.
Na equação química, coloca-se o catalisador em cima da seta que representa a reação química.
Em função dos estados físicos dos reagentes e produtos, a catálise pode ser homogênea ou heterogênea.
Nas indústrias químicas, principalmente a petroquímica, os catalisadores são muito utilizados para acelerar as reações, deixando o processo mais barato.
Uma forma de ver a ação dos catalisadores é adicionando açúcar ao refrigerante. Os refrigerenates carbonatados contém dióxido de carbono (gás carbônico) e pode ser eliminado mais facilmente com adição de açúcar. A reação de eliminação do gás acontece com mais velocidade e percebe-se a formação de bolhas do gás deixando a solução.
Na equação química, coloca-se o catalisador em cima da seta que representa a reação química.
Em função dos estados físicos dos reagentes e produtos, a catálise pode ser homogênea ou heterogênea.
- catálise homogênea: quando reagentes e catalisador estão no mesmo estado físico formando um sistema monofásico.


- catálise heterogênea: quando reagentes e catalisador não estão no mesmo estado físico formando um sistema heterogêneo.
Não existe um tipo ideal de catalisador. Para cada reação química existe um tipo diferente de catalisador. Os catalisadors mais comuns são:
- metais - principalmente os de transição: Co, Ni, Pt, Pd
- ácidos - que catalisam muitas reações orgânicas: H2SO4
- óxidos metálicos ? Al2O3, Fe2O3
- bases - NaOH
- enzimas ? produzidas pelos organismos vivos: lipase, suco gástrico.
- metais - principalmente os de transição: Co, Ni, Pt, Pd
- ácidos - que catalisam muitas reações orgânicas: H2SO4
- óxidos metálicos ? Al2O3, Fe2O3
- bases - NaOH
- enzimas ? produzidas pelos organismos vivos: lipase, suco gástrico.
Inibidores
São substâncias, que ao contrário dos catalisadores, aumentam a energia de ativação e como consequência diminuem a velocidade da reação química. Pode ser chamado também de veneno de catalisador ou anticatalisador. Antigamente era chamado de catalisador negativo.
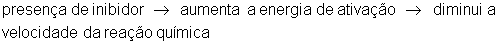
Velocidade Instantânea
é o limite para o qual tende a velocidade média, quando os intervalos de tempo vão se tornando cada vez menores, ou seja, a variação do tempo (D t) tende a zero.
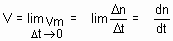
Considere a reação entre zinco com ácido clorídrico formando cloreto de Zinco e liberando gás hidrogênio, conforme a reação: Zn + HCl à ZnCl2 + H2.
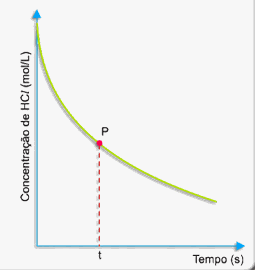
A medida que decorre o tempo, a concentração de ácido clorídrico vai diminuindo conforme o gráfico a seguir:

Como calcular a rapidez (velocidade) da reação nesse instante (tempo t)?
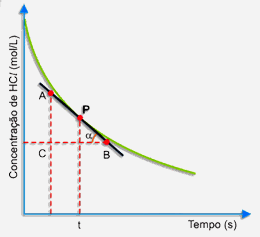
Primeiramente, trace uma tangente à curva pelo ponto P, conforme o desenho a seguir:

Escolha, sobre a tangente, dois pontos A e B. No triângulo retângulo ABC, a tangente trigonométrica do ângulo a é dado por:
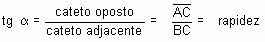
A tangente do ângulo a (inclinação da curva) expressa a velocidade da reação no instante t.
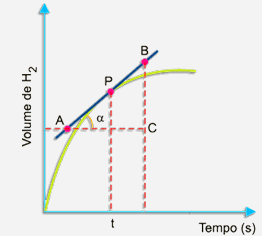
O volume de gás hidrogênio formado aumenta com o passar do tempo. A velocidade no instante t em termos de variação do volume de gás hidrogênio formado com o tempo pode ser calculado pelo mesmo processo. Veja a figura:

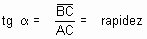
Veja a aplicação dessa teoria em um exercício da Fuvest-SP
O 2-bromobutano (líquido) reage com hidróxido de potássio (em solução de água e álcool) formando o 2-buteno (gasoso) e, em menor proporção, o 1-buteno (gasoso):
C4H9Br + KOH à C4H8 + KBr + H2O.
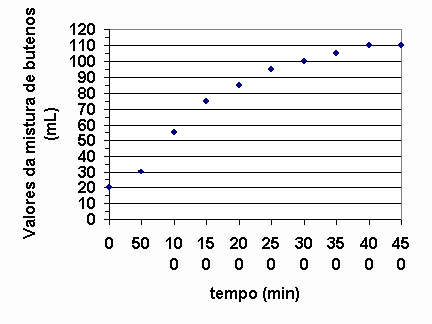
Numa experiência, 137g de 2-bromobuteno e excesso de KOH foram aquecidos a 80O C. A cada 50s o volume da mistura de buteno foi determinado, nas condições ambientais, obtendo-se o gráfico a seguir:

Observando-se o gráfico acima, o que se pode afirmar sobre a velocidade da reação quando se comparam seus volumes médios ao redor de 100, 250 e 400 segundos? Justifique utilizando o gráfico.
Resolução:
Podemos determinar a velocidade instantânea nos instantes solicitados, ou seja, 100, 250 e 400s através do ângulo de inclinação da tangente da curva em cada ponto.
Aproximadamente, calculemos a velocidade da reação ao redor dos valores solicitados:
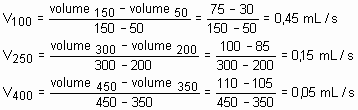
A medida que decorre o tempo, a velocidade da reação diminui.
LEI DE GULDBERG E WAAGE
A Lei da Velocidade ou Lei de Guldberg-Waage foi proposta em 1867, pelos cientistas norugueses Cato Maximilian Guldberg (1836-1902) e Peter Waage (1833-1900). Foi enunciada da seguinte forma:
? A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, para cada temperatura, elevada a expoentes experimentalmente determinados.?
Os expoentes que constam na lei irão determinar a ordem da reação.
Para uma reação genérica, temos:
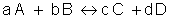
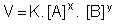
Onde:
V = velocidade da reação
K = constante de velocidade
[A] = concentração molar de A
[B] = concentração molar de B
X e Y = expoentes experimentalmente determinados
Em uma reação elementar, onde ocorre em uma única etapa, o expoente é o coeficiente dos reagentes.
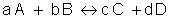
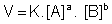
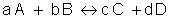
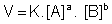
Exemplo:
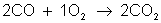
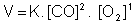
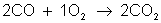
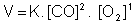
Alguns processos químicos oorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
É fácil entender porque utiliza-se a etapa lenta para determinar a velocidade da reação. Imagine por exemplo uma viagem de ônibus entre as cidades de São Paulo e Rio de Janeiro. Aparentemente, temos a impressão que a viajem vai acontecer em uma única etapa (sair de São Paulo e chagar ao Rio). Mas na prática, há três etapas. A primeira etapa é chegar até a rodoviária (10 minutos), a segunda pegar o ônibus, mais 5horas (300 minutos) e por último, já no Rio de Janeiro, pegar um ônibus até o seu destino (5 minutos). Como a segunda etapa gastou mais tempo, arredondamos a viagem para 5 horas. Com as reações químicas é mais ou menos assim que acontece.
É fácil entender porque utiliza-se a etapa lenta para determinar a velocidade da reação. Imagine por exemplo uma viagem de ônibus entre as cidades de São Paulo e Rio de Janeiro. Aparentemente, temos a impressão que a viajem vai acontecer em uma única etapa (sair de São Paulo e chagar ao Rio). Mas na prática, há três etapas. A primeira etapa é chegar até a rodoviária (10 minutos), a segunda pegar o ônibus, mais 5horas (300 minutos) e por último, já no Rio de Janeiro, pegar um ônibus até o seu destino (5 minutos). Como a segunda etapa gastou mais tempo, arredondamos a viagem para 5 horas. Com as reações químicas é mais ou menos assim que acontece.
Exemplo:
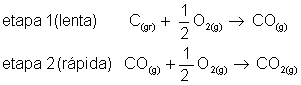
_____________________________________
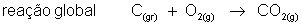
Velocidade da reação: 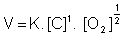
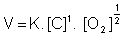
Ordem da Reação e Molecularidade
A ordem de uma reação química só pode ser determinada experimentalmente.
A molecularidade representa o número mínimo de moléculas ou íons reagentes necessários para que ocorram colisões e a reação possa se processar em uma única etapa (elementar).
Os expoentes que estão na lei da velocidade podem determinar a ordem da reação.
A molecularidade representa o número mínimo de moléculas ou íons reagentes necessários para que ocorram colisões e a reação possa se processar em uma única etapa (elementar).
Os expoentes que estão na lei da velocidade podem determinar a ordem da reação.
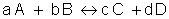
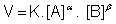
Onde:


Exemplo:
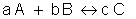
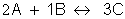
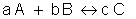
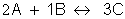
Lei da velocidade: 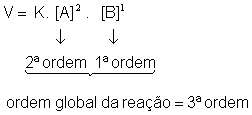

Molecularidade: 3 - trimolecular
A ordem da reação pode indicar o que acontece com a velocidade da reação quando é alterada a concentração dos reagentes.
Ordem | O que acontesse com a concentração |
1ª | Igual |
2ª | Duplica (quadrado) |
3ª | Ao cubo |
Veja o exemplo:
Seja a equação química:
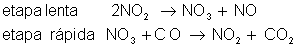
Responda:
a) equação da velocidade: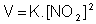
Seja a equação química:
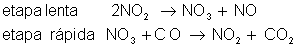
Responda:
a) equação da velocidade:
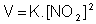
b) ordem da reação: 2ª ordem
c) o que acontece com a velocidade quando a concentração de NO2 é dobrada? 2² = 4 (a velocidade aumenta 4 vezes).
d) o que acontece com a velocidade quando a concentração do CO é dobrada? Não acontece nada porque a concentração do CO não altera nada. A sua ordem é zero.
Fonte: http://luizclaudionovaes.sites.uol.com.br/enerat1.gif
Fonte: http://www.brasilescola.com/
http://www.soq.com.br/conteudos/em/cineticaquimica/p7.php
- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Exercícios Bioquímica
Aqui estão algumas questões de vestibulares sobre Bioquímica. Para conferir o gabarito selecione o texto no final de cada questão (Resposta: letra X). 1. (UNIR/RO) A mandioca, rica em amido, constitui o principal alimento energético de muitas famílias...
- Exercícios Resolvidos Estudo Dos Gases
Gases:1. Qual a velocidade média das moléculas de um gás que ocupa um recipiente de capacidade igual a 2 litros, tem massa igual a 20 gramas e pressão equivalente a 2 atmosféras?Lembrando que existe uma relação entre estas grandezas expressa por:...
- Questões E Resumo Sobre Energia Livre De Gibbs
Energia livre de GibbsEnergia livre de Gibbs é a energia de que o processo dispõe para realizar trabalho útil em temperatura e pressão constantes.Visto que em um processo a energia nunca é totalmente convertida em trabalho, a fração de energia...
- Equlibrio Químico - Questões Resolvidas De Vestibulares
Artigo sobre Equilíbrio químico com resumo e exercícios resolvidos de vestibulares. Equilíbrio químico é uma reação reversível na qual a velocidade da reação direta é igual à da reação inversa e, conseqüentemente, as concentrações...
