Vestibular

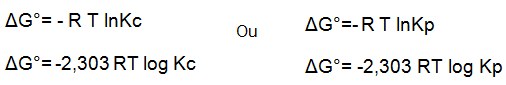
Questões sobre Energia livre de Gibbs
1) (UEPA) Uma reação química apresentou, a 27°C, uma variação de entalpia igual a -224,52 kcal e uma variação de entropia igual a 1,5cal/ K.mol. A variação da energia livre de Gibbs para essa reação é:
a)-674,52 cal/mol b)-674,52 kcal/mol c) -224,97 kcal/mol d) -224,97 cal/mol e) 674,52 kcal/mol .
Lembrem-se a fórmula para o cálculo da energia livre de Gibbs é G = H- TS , onde:
G = energia livre de Gibbs
H = variação de entalpia
T = temperatura em Kelvin
S = Variação da entropia
Obs: Não consegui colocar o símbolo delta referente à variação.
Dica: Para memorizar a fórmula se lembre da frase:"Gente, Hoje Tem Sol".
Solução: 27°C = 300k
1,5cal/ K.mol = 0,0015kcal/mol
G = H- TS
G = -224,52 - (300 . 0,0015)
G = -224,52 - 0,45
G = -224,97 kcal/mol.
2) Calcule a variação de energia livre da formação da amônia a 25ºC e 1atm. Quando ?Hº= -46,11KJ?mol-1 e ?Sº=-99,37 J?K-1?mol-1, de acordo com a reação: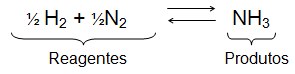
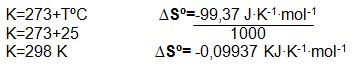
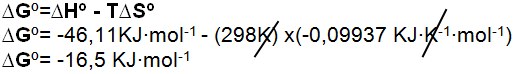
- Exercícios Resolvidos Estudo Dos Gases
Gases:1. Qual a velocidade média das moléculas de um gás que ocupa um recipiente de capacidade igual a 2 litros, tem massa igual a 20 gramas e pressão equivalente a 2 atmosféras?Lembrando que existe uma relação entre estas grandezas expressa por:...
- Termologia
A Termologia ou Termofísica é a parte da Física que estuda o calor. Para melhorar a organização do blog, vou postar nesta aqui, alguns dos textos que já temos sobre Termologia. Temperatura e Calor Iniciamos o estudo da termologia com o conceito...
- Questões De Vestibulares Resolvidas - Escalas Celsius Fahrenheit E Kelvin
Calor e Temperatura O Calor é a energia transferida de um corpo para o outro quando existe diferença de temperatura. Já temperatura é a medida de agitação das moléculas. Por exemplo: ao colocarmos gelo no suco, as moléculas do suco estão...
- Questões Resolvidas De Vestibulares De Termodinâmica
Questões resolvidas de vestibulares sobre 1ª e 2ª Lei da Termodinâmica, Energia Interna, Ciclo de Cannot e trabalho de um gás 1) Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna...
- Termoquímica - Entalpia, Lei De Hess, Energia De Ligação E Entropia (com Questões)
Termoquímica A Termoquímica estuda o calor da reação provocada pela troca de energia do meio externo com os reagentes. Toda reação química absorve ou gera calor, ou seja, há sempre uma troca de energia. A emissão ou absorção de luz, de...
Vestibular
Questões e resumo sobre Energia livre de Gibbs
Energia livre de Gibbs
Energia livre de Gibbs é a energia de que o processo dispõe para realizar trabalho útil em temperatura e pressão constantes.
Visto que em um processo a energia nunca é totalmente convertida em trabalho, a fração de energia útil do sistema, isto é, que realiza o trabalho, é considerada a energia livre.
A grandeza da energia livre só é usada para calcular variações que ocorrem nos sistemas, e não para sistemas estáticos. Ela é simbolizada por ?G. É também denominada Energia Livre de Gibbs, pois foi proposta em 1878, pelo físico americano Josiah Willard Gibbs (1839-1903), com a finalidade de avaliar a espontaneidade do sistema.
Seu cálculo é dado pela expressão matemática abaixo, que é costumeiramente chamada de equação de Gibbs-Helmholtz:

Em que:
?G = variação da energia livre;
?H = variação da entalpia;
T = temperatura em Kelvin (sempre positiva);
?S = variação da entropia.
?H = variação da entalpia;
T = temperatura em Kelvin (sempre positiva);
?S = variação da entropia.
Para entendermos melhor como essa equação nos ajuda a determinar a espontaneidade de uma reação, relembremos brevemente cada um dos conceitos envolvidos nela:
- ?H (variação da entalpia): Entalpia (H) é o conteúdo de energia de uma substância. Até o momento, não é conhecida nenhuma maneira de determiná-la. Na prática, o que se consegue é medir a variação da entalpia (?H) de um processo, utilizando-se calorímetros. Essa variação é a quantidade de energia que foi liberada ou absorvida no processo.
- ?S (variação da entropia): A entropia (S) é a grandeza termodinâmica que mede o grau de desordem de um sistema.
Por exemplo, na fusão do gelo, as moléculas passam do estado sólido para o líquido, onde há uma maior desorganização. Isso significa que nesse processo a entropia aumentou (?S > 0).
Na produção da amônia (NH3), 1 mol de gás nitrogênio reage com 3 mol de gás hidrogênio (ou seja, 4 mol de moléculas nos reagentes), originando 2 mol de amônia:
N2(g) +3 H2(g) ? 2 NH3(g)
Visto que o número de moléculas na fase gasosa diminui nesse processo, a desorganização diminuiu, o que significa que a entropia também diminuiu (?S< 0).
- ?G (Energia livre): A energia livre ou energia livre de Gibbs (porque foi proposta apenas por esse cientista em 1878) é a energia útil do sistema que é usada para realizar trabalho.
Um sistema possui uma energia global, mas apenas uma fração dessa energia será usada para realizar trabalho, essa é a chamada energia livre de Gibbs, simbolizada por G.
Segundo Gibbs, um processo é considerado espontâneo se realizar trabalho, ou seja, se G diminuir.Nesse caso, o estado final da transformação será mais estável que o inicial quando ?G < 0.
Baseado nisso, podemos concluir o seguinte:
| ?G= 0 | Sistema atingiu equilíbrio dinâmico |
| ?G= positiva | A reação ocorre em favor dos reagentes |
| ?G= negativa | Segue para o estado de equilíbrio |
Ou expressando por meio das equações:
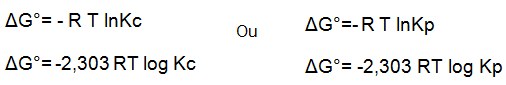
Onde : R é a constante de Boltzman ou seja R= 0,082 L atm-1
T é temperatura em Kelvins(K) onde K= T em °C + 273,15
Eletroquímica e ?G°
Quando ?G° se aproxima de zero em uma célula eletroquímica, esta atingiu o equilíbrio. Onde, os reagentes e os produtos encontram-se na mesma quantidade e a bateria descarregou sua carga dizemos que este sistema encontra-se em equilíbrio. Diante disso um cientista chamado Nernest deduziu uma equação capaz de fornecer a força eletromotriz (fem) através da energia livre, ?por que a energia livre é proporcional a fem que depende da concentração dos reagentes na célula.? Essa relação é mais bem expressa através das equações:
?G= ?G° + RTlnK onde:
?G= -nFE e ?G°=-nFEº substituindo,
-nfE=-nFEº+RT lnK dividindo os termos por ?nF temos:
E=Eº- RT/nF lnK ( Equação de Nernest)
Questões sobre Energia livre de Gibbs
1) (UEPA) Uma reação química apresentou, a 27°C, uma variação de entalpia igual a -224,52 kcal e uma variação de entropia igual a 1,5cal/ K.mol. A variação da energia livre de Gibbs para essa reação é:
a)-674,52 cal/mol b)-674,52 kcal/mol c) -224,97 kcal/mol d) -224,97 cal/mol e) 674,52 kcal/mol .
Lembrem-se a fórmula para o cálculo da energia livre de Gibbs é G = H- TS , onde:
G = energia livre de Gibbs
H = variação de entalpia
T = temperatura em Kelvin
S = Variação da entropia
Obs: Não consegui colocar o símbolo delta referente à variação.
Dica: Para memorizar a fórmula se lembre da frase:"Gente, Hoje Tem Sol".
Solução: 27°C = 300k
1,5cal/ K.mol = 0,0015kcal/mol
G = H- TS
G = -224,52 - (300 . 0,0015)
G = -224,52 - 0,45
G = -224,97 kcal/mol.
Alternativa "C".
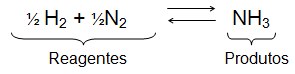
Solução:
1: Transformar a temperatura que está em Celsius para Kelvin e a variação de entropia de J?K-1?mol-1 para KJ?K-1?mol-1.
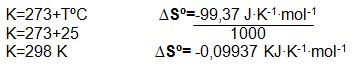
2: substituir na equação os dados:
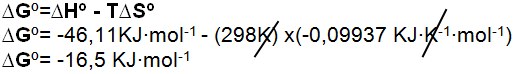
3) Se ? G < 0 para uma reação a todas as temperaturas, então ? S é ________ e ? H é ________.
a) positivo, positivo b) positivo, negativo c) zero, positivo d) negativo, positivo e) negativo, zero
Solução: Letra B
4) O ácido sulfúrico concentrado diluindo-se em água pode ser perigoso.A temperatura da solução pode aumentar rapidamente. Que são os sinais de ? H, de ? S, e de ? G para este processo?
a) ? H < 0, ? S < 0, ? G < 0 b) ? H < 0, ? S > 0, ? G < 0 c) ? H < 0, ? S > 0, ? G < 0
d) ? H > 0, ? S > 0, ? G < 0 e) ? H > 0, ? S < 0, ? G > 0
Solução: Letra B
5) Todas as seguintes substâncias têm uma energia livre igual a zero EXCETO:
a) He(g). b) O(g). c) S8 (s). d) Cu(s). e) Cl2 (g).
Solução: Letra B
6) Considere a vaporização de um líquido a temperatura igual a seu ponto normal de ebulição, por exemplo, vaporização da água a 373.15 K e pressão de 1 atm H2O(l) ? H2O(g) ? calcule a energia de Gibbs molar de vaporização
Solução:
? a uma dada temperatura, teremos
?vap,mG =Gm[H2O(g)] ? Gm[H2O(l)] =?vap,mH ? T ?vap,mS =40, 65 kJ · mol?1 ? T × (108, 9 kJ · K ?1 · mol?1 )
? para T = 373.15 K, ?vap,mG = 40, 65 kJ · mol?1 ? 373.15 K × (108, 9 kJ · K ?1 · mol?1 ) = 0
7) Um mol de gás ideal a 298K expande isotermicamente contra o vácuo de um volume de 2 litros para um de 8 litros. Calcule q, w, ?U, ?A, ?G, ?H, ?Ssist, ?Sviz e ?Suniv para o processo. Como se pode avaliar se o processo é espontâneo?
Solução:
- ?G = - 110,6 kJ; a reação é espontânea sob o ponto de vista de ?G.
- a) P; b) P; c) N; d) N; e) P; f) P
- Letra a! Basta fazer o cálculo para verificar que a reação será espontânea para qualquer temperatura, uma vez que temos variação de entalpia negativa e variação de entropia positiva.
Resposta à pergunta: Porque há também um reagente no estado gasoso. Assim, como a entropia do gás é muito maior do que a entropia do sólido, a passagem de C(s) para CO2(g) apresenta pouca influência, uma vez que já existe a passagem O2(g) para CO2(g).
- Haja vista que temos um processo de difusão de gases, o mesmo sempre será espontâneo, independente da óptica observada. Como tem-se T e P constantes, o cálculo de ?G conduzirá, necessariamente, a um valor negativo. Letra a!
- Letra e! Como a pressão no recipiente em A é maior do que em B, o pistão se deslocará para B no intuito de ocorrer equalização da pressão. E esse processo será espontâneo e não forçado!
- ?A = ?G = - 58,8 kJ.
- q = 0, w = 0, ?U = 0, ?A = - 3434,6 J/mol, ?G = 3434,6 J/mol, ?H = 0, ?Ssist = + 11,52 J/(K mol), ?Sviz = 0 e ?Suniv = + 11,52 J/(K mol).
Nesse caso, avalia-se a espontaneidade do processo através do cálculo de entropia do universo que, necessariamente, deverá levar a um valor positivo, pois sabe-se que o processo de expansão contra o vácuo é espontâneo.
- Exercícios Resolvidos Estudo Dos Gases
Gases:1. Qual a velocidade média das moléculas de um gás que ocupa um recipiente de capacidade igual a 2 litros, tem massa igual a 20 gramas e pressão equivalente a 2 atmosféras?Lembrando que existe uma relação entre estas grandezas expressa por:...
- Termologia
A Termologia ou Termofísica é a parte da Física que estuda o calor. Para melhorar a organização do blog, vou postar nesta aqui, alguns dos textos que já temos sobre Termologia. Temperatura e Calor Iniciamos o estudo da termologia com o conceito...
- Questões De Vestibulares Resolvidas - Escalas Celsius Fahrenheit E Kelvin
Calor e Temperatura O Calor é a energia transferida de um corpo para o outro quando existe diferença de temperatura. Já temperatura é a medida de agitação das moléculas. Por exemplo: ao colocarmos gelo no suco, as moléculas do suco estão...
- Questões Resolvidas De Vestibulares De Termodinâmica
Questões resolvidas de vestibulares sobre 1ª e 2ª Lei da Termodinâmica, Energia Interna, Ciclo de Cannot e trabalho de um gás 1) Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna...
- Termoquímica - Entalpia, Lei De Hess, Energia De Ligação E Entropia (com Questões)
Termoquímica A Termoquímica estuda o calor da reação provocada pela troca de energia do meio externo com os reagentes. Toda reação química absorve ou gera calor, ou seja, há sempre uma troca de energia. A emissão ou absorção de luz, de...
