Vestibular
Resolução:
Mg Si O3
+2 +x -2
podemos afirmar o Nox do magnésio ,porque este pertence a família IIA, o que lhe confere Nox = +2
e o Nox do oxigênio vale = - 2
Assim devemos encontrar o valor do Nox do silício
Mg Si O3
+2 +x -2
+2 +x -6 = 0 ( moléculas neutras tem Nox = 0 )
para resolver o exercício temos que resolver a equação de 1. Grau
+2 +x -6 = 0
+x ? 4 = 0
+x = 4
o Nox do silício nesta molécula vale +4.
2) (Puccamp ? SP) Descobertas recentes da Medicina indicam a eficiência do óxido nítrico (NO) no tratamento de determinado tipo de pneumonia. Sendo facilmente oxidado pelo oxigênio e NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha O2. Os números de oxidação do nitrogênio no NO e NO2 são, respectivamente:
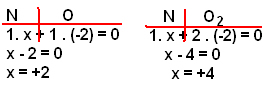 3) Determine os números de oxidação para cada elemento das espécies químicas abaixo:
3) Determine os números de oxidação para cada elemento das espécies químicas abaixo:
a) HBr
b) ClO4-
c) H2O2
d) NaCl
e) MnBr2
f) Na2S2O3
Resolução:
a) HBr
H = +1 ; Br = -1
b) ClO4-
Cl = +7 ; O = -2
c) H2O2
H =+1; O = -1
d) NaCl
Na = +1; Cl = -1
e) MnBr2
Mn = +2; Br = -1
f) Na2S2O3
Na = +1; S = +2; O = -2
4) O enxofre é um sólido amarelo encontrado livre na natureza em regiões onde ocorrem fenômenos vulcânicos. As suas variedades alotrópicas são o rômbico e o monoclínico. Esse elemento participa de várias substâncias e íons, tais como: S8, H2S, SO2, H2SO4, H2SO3, SO3, SO42- e Al2(SO4)3.
Determine os Nox do enxofre em cada uma dessas espécies químicas.
Resolução:
S8: Nox = 0
H2S: Nox = -2
SO2: Nox = +4
H2SO4: Nox = +6
H2SO3: Nox = +4
SO3: Nox = +6
SO42-: Nox = +6
Al2(SO4)3: Nox = +6
5) (Uerj 2008) O nitrogênio atmosférico, para ser utilizado pelas plantas na síntese de substâncias orgânicas nitrogenadas, é inicialmente transformado em compostos inorgânicos, por ação de bactérias existentes no solo.
No composto inorgânico oxigenado principalmente absorvido pelas raízes das plantas, o número de oxidação do nitrogênio corresponde a:
a) 0
b) + 1
c) + 2
d) + 5
6) (Pucrs 2003) O número de oxidação do átomo de carbono nas estruturas CH4, HCHO e CO32- é, respectivamente,
13) (MACKENZIE-SP) sabendo que o cloro pertence à família dos halogênios, a substância na qual o cloro apresenta número de oxidação máximo é:
15) O elemento X reage com o elemento Z, conforme o processo:
19) O aumento de diferença de eletronegatividade entre os elementos ocasiona a seguinte ordem no caráter das ligações
a) covalente polar, covalente apolar, iônica.
b) iônica, covalente polar, covalente apolar.
c) covalente apolar, iônica, covalente polar.
d) covalente apolar, covalente polar, iônica.
e) iônica, covalente apolar, covalente polar.
20) A ligação C - H é praticamente apolar devido a uma pequena diferença de eletronegatividade entre os átomos. Nessas condições, é apolar a molécula
Gabarito:
5) D 6) B 7) B 8) A 9) D 10) A 11) A 12) E 13) D 14) B 15) B 16) E 17) E 18) A
19) D 20) E


- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Diferença Entre Dissociação Iônica E Ionização
Na água, os compostos iônicos sofrem dissociação, e os moleculares sofrem ionização Se colocarmos cloreto de sódio, o sal de cozinha (NaCl), em um recipiente contendo água, o que ocorrerá é que os íons já existentes no retículo cristalino...
- Simulado De Química
1-) NH 3 , H 2 O e CH 4 são, respectivamente, moléculas: a) polar, polar, apolar b) polar, polar, polar c) apolar, apolar, polar d) polar, apolar, apolar e) apolar, apolar, apolar 2-) (MED ? SANTOS) Nas dispersões coloidais, o diâmetro das partículas...
- Geometria Molecular Resumo(com Questões)
Geometria molecular A geometria molecular explica como estão dispostos os átomos dentro da molécula. Os átomos tendem a ficar numa posição mais espaçada, esparramada possível. Assim conseguem adquirir a estabilidade. As geometrias moleculares...
- Interações Intermoleculares Resumo (com Questões)
INTERAÇÕES INTERMOLECULARES As moléculas se atraem. Deste fato simples, surgem importantes conseqüências. Rios, lagos e oceanos existem porque as moléculas se atraem e formam um líquido. Sem esse líquido não haveria vida. Sem as forças entre...
Vestibular
Número de oxidação resumo (com questões)
Número de oxidação
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon.
O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon. Exemplos:
O2-: Nox = -2
Cl-: Nox = -1
Na+: Nox = +1
Fe2+: Nox = +2
Al3+: Nox = +3
Cl-: Nox = -1
Na+: Nox = +1
Fe2+: Nox = +2
Al3+: Nox = +3
O nox de um elemento numa molécula e num íon composto é a carga que teria o átomo desse elemento supondo que os elétrons das ligações covalentes e dativas se transferissem totalmente do átomo menos eletronegativo para o mais eletronegativo, como se fosse uma ligação iônica.
| Elementos com nox fixo em seus compostos |
|---|
| metais alcalinos (+1) |
| metais alcalino-terroso (+2) |
| alumínio (+3) |
| prata (+1) |
| zinco (+2) |
O oxigênio é o mais eletronegativo de todos os elementos, exceto o flúor. O oxigênio tem nox negativo em todos os seus compostos, exceto quando ligado ao flúor.
Na grande maioria de seus compostos, o oxigênio tem nox = -2. Nos peróxidos (grupo -O-O-) o oxigênio tem nox = -1.
O hidrogênio é menos eletronegativo que todos os não-metais e semimetais; por isso, quando ligado a esses elementos, tem nox positivo e sempre igual a +1.
O hidrogênio é mais eletronegativo que os metais; por isso, quando ligado a esses elementos, tem nox negativo e sempre igual a -1.
Superóxidos: -1/2
K2O4 NOX O = - 1/2
Superóxidos: -1/2
K2O4 NOX O = - 1/2
A soma dos nox de todos os átomos de:
Uma molécula é igual a zero.Um íon composto é igual à carga do íon.
O nox de qualquer elemento sob forma de substância simples é igual a zero.
Ex: O2, Ca, Al, He, etc.
Ex: O2, Ca, Al, He, etc.
O nox máximo de um elemento é igual ao número do grupo onde está o elemento na Tabela Periódica, com exceção dos elementos do Grupo VIIIB.
O nox mínimo é igual a (número do grupo - 8),no caso de o elemento ser um não-metal ou um semimetal.
Observação: Essa última regra é a mais importante, pois por meio dela é possível verificar se os Nox dos elementos estão corretos.
Veja agora como usar essas informações para determinar o Nox dos átomos de vários compostos:
- H3PO4:
- O Nox do H é +1 e do O é -2;
- Esse composto é molecular, portanto, a soma dos Nox dará igual a zero;
- Para determinar o Nox do fósforo (P) realizamos a seguinte conta:
H3 P O4
3 . (+1) + x + 4 . (-2) = 0
3 + x -8 = 0
x = +8 ? 3
x = +5
3 + x -8 = 0
x = +8 ? 3
x = +5
- Al2(SO4)3:
- O Nox de Al é igual a +3;
- O Nox do O é igual a -2;
- A soma dos Nox é igual a zero.
Al2 (S)3 (O4)3
2 . (+3) + 3. x + 4 . 3. (-2) = 0
6 + 3. x - 24 = 0
3. x = +24 ? 6
X = 18/3
x = +6
6 + 3. x - 24 = 0
3. x = +24 ? 6
X = 18/3
x = +6
- Cr2O72-
- O Nox do O é igual a -2;
- Esse caso constitui um agrupamento iônico com carga total igual a -2, portanto, a soma dos Nox dos átomos constituintes não deve ser igual a zero, mais sim igual a essa carga.
Cr2 O72-
2. x + 7. (-2) = -2
2. x -14 = - 2
2. x = -2 +14
x = 12/2
x = 6
2. x -14 = - 2
2. x = -2 +14
x = 12/2
x = 6
Nox e valência - O nox de um elemento na forma de um íon monoatômico é igual à sua eletrovalência. O nox de um elemento na forma de molécula ou de íon composto não é obrigatoriamente igual à sua valência. A valência, nesses casos, é dada pelo número de ligações covalentes e dativas. Cada ligação covalente conta como uma unidade de valência, e cada ligação dativa, como duas unidades de valência.
Exemplos:
HCl
Hidrogenio se enquadra na regra 1 -> nox +1
O cloro se enquadra na regra 6 -> nox -1
O cloro se enquadra na regra 6 -> nox -1
1 ? 1 = 0 (regra 8)
HClO
Hidrogênio -> nox +1
Cl -> não há regra que se aplica
Oxigênio -> nox -2
Cl -> não há regra que se aplica
Oxigênio -> nox -2
nox H + nox Cl + nox O = 0 , logo 1 + x + (-2) = 0, logo o NOX do Cloro será +1
OBSERVAÇÃO: um átomo que não se encaixe as regras (como o Cloro), não precisa ter o mesmo NOX em todas as moléculas. Acima notamos que no HCl, ele tem NOX = -1 , e no HClO, tem nox +1
CaCO3
Neste caso, precisamos multiplicar o nox, das regras, pelo numero de átomos do elemento na molécula.
NOX oxigênio = -2 . 3 (porque são 3 átomos de oxigênio!)
NOX Ca = alcalino terroso = +2
Para descobrir o NOX do Carbono:
(-2 . 3) + 2 + X = 0
-6 + 2 + X = 0
NOX Ca = alcalino terroso = +2
Para descobrir o NOX do Carbono:
(-2 . 3) + 2 + X = 0
-6 + 2 + X = 0
Logo o NOX do carbono será +4
Moléculas orgânicas polares e apolares
A capacidade que as ligações possuem de atrair cargas elétricas se define como Polaridade, esta assume caráter diferente dependendo da ligação onde se faz presente.
Em relação à ligação iônica e covalente, qual delas seria polar ou apolar?
Os compostos iônicos são carregados de cargas elétricas: cátions e ânions, que são chamados de polos positivos e negativos respectivamente. Estes são representados pelos sinais ?+ e ?-. As substâncias iônicas reagem com outros compostos em razão da presença destes polos que tornam a ligação instável. Exemplo: a ligação iônica dos átomos de Cloro e Sódio dá origem ao composto cloreto de sódio (Na+Cl-), popularmente conhecido como sal de cozinha.
Resumindo: Toda ligação iônica é uma ligação polar.
Já os compostos covalentes se classificam na maioria como apolares.
Mas lembre-se: não significa que todo composto covalente é apolar. Os polos estão associados à eletronegatividade, se a ligação covalente for entre átomos de mesma eletronegatividade a ligação será apolar, porque não ocorre formação de polos.
Exemplo: o composto covalente C3H8 (Propano) é apolar, vejamos por que:
H H H
? ? ?
H ? C ? C ? C ? H
? ? ?
H H H Observe que a ligação ocorre entre elementos iguais, portanto possuem mesma escala de eletronegatividade.
Em relação à ligação iônica e covalente, qual delas seria polar ou apolar?
Os compostos iônicos são carregados de cargas elétricas: cátions e ânions, que são chamados de polos positivos e negativos respectivamente. Estes são representados pelos sinais ?+ e ?-. As substâncias iônicas reagem com outros compostos em razão da presença destes polos que tornam a ligação instável. Exemplo: a ligação iônica dos átomos de Cloro e Sódio dá origem ao composto cloreto de sódio (Na+Cl-), popularmente conhecido como sal de cozinha.
Resumindo: Toda ligação iônica é uma ligação polar.
Já os compostos covalentes se classificam na maioria como apolares.
Mas lembre-se: não significa que todo composto covalente é apolar. Os polos estão associados à eletronegatividade, se a ligação covalente for entre átomos de mesma eletronegatividade a ligação será apolar, porque não ocorre formação de polos.
Exemplo: o composto covalente C3H8 (Propano) é apolar, vejamos por que:
H H H
? ? ?
H ? C ? C ? C ? H
? ? ?
H H H
Observe que a ligação ocorre entre elementos iguais, portanto possuem mesma escala de eletronegatividade.? ? ?
H ? C ? C ? C ? H
? ? ?
H H H
Exercícios
1) Calcule o número de oxidação da substância MgSiO3
Resolução:
Mg Si O3
+2 +x -2
podemos afirmar o Nox do magnésio ,porque este pertence a família IIA, o que lhe confere Nox = +2
e o Nox do oxigênio vale = - 2
Assim devemos encontrar o valor do Nox do silício
Mg Si O3
+2 +x -2
+2 +x -6 = 0 ( moléculas neutras tem Nox = 0 )
para resolver o exercício temos que resolver a equação de 1. Grau
+2 +x -6 = 0
+x ? 4 = 0
+x = 4
o Nox do silício nesta molécula vale +4.
2) (Puccamp ? SP) Descobertas recentes da Medicina indicam a eficiência do óxido nítrico (NO) no tratamento de determinado tipo de pneumonia. Sendo facilmente oxidado pelo oxigênio e NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha O2. Os números de oxidação do nitrogênio no NO e NO2 são, respectivamente:
a) + 3 e + 6.
b) + 2 e + 4.
c) + 2 e + 2.
d) zero e + 4.
e) zero e + 2.
Resolução:
Alternativa ?b?
Lembre-se que a soma dos Nox na substância deve dar igual a zero e que o Nox do oxigênio é -2. Assim, temos:
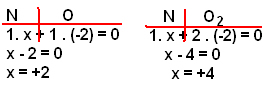
a) HBr
b) ClO4-
c) H2O2
d) NaCl
e) MnBr2
f) Na2S2O3
Resolução:
a) HBr
H = +1 ; Br = -1
b) ClO4-
Cl = +7 ; O = -2
c) H2O2
H =+1; O = -1
d) NaCl
Na = +1; Cl = -1
e) MnBr2
Mn = +2; Br = -1
f) Na2S2O3
Na = +1; S = +2; O = -2
4) O enxofre é um sólido amarelo encontrado livre na natureza em regiões onde ocorrem fenômenos vulcânicos. As suas variedades alotrópicas são o rômbico e o monoclínico. Esse elemento participa de várias substâncias e íons, tais como: S8, H2S, SO2, H2SO4, H2SO3, SO3, SO42- e Al2(SO4)3.
Determine os Nox do enxofre em cada uma dessas espécies químicas.
Resolução:
S8: Nox = 0
H2S: Nox = -2
SO2: Nox = +4
H2SO4: Nox = +6
H2SO3: Nox = +4
SO3: Nox = +6
SO42-: Nox = +6
Al2(SO4)3: Nox = +6
5) (Uerj 2008) O nitrogênio atmosférico, para ser utilizado pelas plantas na síntese de substâncias orgânicas nitrogenadas, é inicialmente transformado em compostos inorgânicos, por ação de bactérias existentes no solo.
No composto inorgânico oxigenado principalmente absorvido pelas raízes das plantas, o número de oxidação do nitrogênio corresponde a:
a) 0
b) + 1
c) + 2
d) + 5
6) (Pucrs 2003) O número de oxidação do átomo de carbono nas estruturas CH4, HCHO e CO32- é, respectivamente,
a) +4 0 -4
b) -4 0 +4
c) 0 +4 -4
d) -4 -4 0
e) +4 +4 -4
b) -4 0 +4
c) 0 +4 -4
d) -4 -4 0
e) +4 +4 -4
7) (Ufrs 2007) No ânion tetraborato, B4O72-, o número de oxidação do boro é igual a
a) 2.
b) 3.
c) 4.
d) 5.
e) 7.
b) 3.
c) 4.
d) 5.
e) 7.
8) (Unesp 2008) O nitrogênio pode existir na natureza em vários estados de oxidação. Em sistemas aquáticos, os compostos que predominam e que são importantes para a qualidade da água apresentam o nitrogênio com números de oxidação -3, 0, +3 ou +5. Assinale a alternativa que apresenta as espécies contendo nitrogênio com os respectivos números de oxidação, na ordem descrita no texto.
a) NH3, N2, NO2-, NO3-.
b) NO2-, NO3-, NH3, N2.
c) NO3-, NH3, N2, NO2-.
d) NO2-, NH3, N2, NO3-.
e) NH3, N2, NO3-, NO2-.
b) NO2-, NO3-, NH3, N2.
c) NO3-, NH3, N2, NO2-.
d) NO2-, NH3, N2, NO3-.
e) NH3, N2, NO3-, NO2-.
9) (Ufsm 2004) As usinas hidroelétricas, que utilizam a água acumulada em represas para fazer funcionar suas turbinas, são responsáveis pela perturbação no ciclo natural das cheias e secas dos rios, pela inundação de áreas de terra cada vez maiores, pela retenção de nutrientes que, se não fosse esse uso, estariam distribuídos mais ou menos uniformemente, ao longo dos rios.
A queima de carvão mineral para a geração do vapor d'água que move as turbinas das usinas termoelétricas lança, na atmosfera, além de dióxido de carbono, grandes quantidades de enxofre e óxidos nitrogenados, gases que formam a chuva ácida. As usinas nucleares causam impacto ambiental mesmo na ausência de acidentes, porque retiram a água do mar ou dos rios para resfriar os núcleos de seus geradores, devolvendo-a a uma temperatura bem mais alta. Esse aquecimento afeta os organismos aquáticos, pois o aumento da temperatura deixa a água pobre em oxigênio pela diminuição da solubilidade.
Com a diminuição do pH, não há mais proteção da ferragem. No processo de oxidação do ferro, há expansão de volume e conseqüente fragmentação do concreto.
As equações que podem representar a formação da ferrugem pela ação do CO2 e da água são:
As equações que podem representar a formação da ferrugem pela ação do CO2 e da água são:
1) Fe+CO2+H2O  FeCO3+H2
FeCO3+H2
 FeCO3+H2
FeCO3+H22) FeCO3+CO2+H2O  Fe(HCO3)2
Fe(HCO3)2
 Fe(HCO3)2
Fe(HCO3)23) 4Fe(HCO3)2+O2  2(Fe2O3 . 2 H2O)+8CO2
2(Fe2O3 . 2 H2O)+8CO2
 2(Fe2O3 . 2 H2O)+8CO2
2(Fe2O3 . 2 H2O)+8CO2O número de oxidação do ferro nos compostos Fe(HCO3)2 e Fe2O3 . 2 H2O é, respectivamente,
a) +1 e +2
b) +1 e +3
c) +2 e +2
d) +2 e +3
e) +3 e +3
b) +1 e +3
c) +2 e +2
d) +2 e +3
e) +3 e +3
10) (Puc-rio 2003) Indique o número de oxidação de cada elemento nos respectivos compostos, relacionando as colunas:
I) Ca em CaCO3
II) Cl em HCl
III) Na em Na2SO4
IV) N em HNO3
V) O em O2
II) Cl em HCl
III) Na em Na2SO4
IV) N em HNO3
V) O em O2
( ) -1
( ) 0
( ) +1
( ) +2
( ) +5
( ) 0
( ) +1
( ) +2
( ) +5
Marque a opção que corresponde à seqüência correta de cima para baixo
a) II, V, III, I, IV.
b) II, V, III, IV, I.
c) III, IV, II, I, V.
d) V, II, I, III, IV.
e) V, III, II, I, IV.
b) II, V, III, IV, I.
c) III, IV, II, I, V.
d) V, II, I, III, IV.
e) V, III, II, I, IV.
11) (UFPB 2008) Nos feldspatos alcalinos, os átomos de oxigênio possuem estado de oxidação ?2. Assim, é correto afirmar que, no feldspato de fórmula KAlSi3O8, os elementos K, Al e Si possuem, respectivamente, os seguintes estados de oxidação:
a) +1, +3,+4
b) +2, +3, -3
c) -2, +2, +3
d) +1, -3, +4
e) +1, +3, +2
12) (UFPB 2008) No Sulfato de cálcio (CaSO4), os átomos de oxigênio apresentam estado de oxidação ?2 e o Ca, estado de oxidação +2. A partir dessas informações, é correto afirmar:
a) O íon Ca+2 possui configuração eletrônica 1s22s22p63s23p2
b) O íon Ca+2 possui 20 prótons e 20 elétrons.
c) O íon O?2 possui 8 prótons e 6 elétrons.
d) O íon O?2 possui configuração eletrônica 1s22s22p4.
e) Os elétrons mais energéticos do O?2 possuem números quânticos, principal e secundário, iguais a 2 e 1, respectivamente.
a) Cl2O5.
b) HCl.
c) Cl2O.
d) HClO4.
e) Cl2.
14) O processo em que um átomo cede elétron a outro é denominado transformação de oxidorredução que pode ser identificada na situação seguinte:
a) Envelhecimento do ouro.
b) Formação de ferrugem.
c) Conservação de alimentos.
d) Dissolução de comprimidos efervescentes.
e) Reação de neutralização entre um ácido e uma base de Arrhenius.
15) O elemento X reage com o elemento Z, conforme o processo:
Z3? + X ? Z1? + X2?
Nesse processo:
a) Z ganha elétrons de X.
b) X ganha elétrons de Z.
c) X e Z cedem elétrons.
d) X e Z perdem elétrons.
e) X e Z cedem e ganham elétrons, respectivamente.
16) Na reação de oxi-redução H2S + I2 ? S + 2HI, as variações dos números de oxidação do enxofre e do iodo são, respectivamente:
a) +2 para zero e zero para +1.
b) zero para +2 e +1 para zero.
c) zero para -2 e -1 para zero.
d) zero para -1 e -1 para zero.
e) ?2 para zero e zero para -1.
17) Assinale a alternativa cuja equação química não representa uma reação de oxi-redução:
a) N2 + H2 ? 2NH3.
b) Cl2 + NaI ? NaCl + I2.
c) Fe + HCl ? FeCl2 + H2.
d) C2H6O + O2 ? CO2 + H2O.
e) Na2O + HCl ? NaCl + H2O.
18) NH3, H2O e CH4 são, respectivamente, moléculas
a) polar, polar, apolar.
b) polar, polar, polar.
c) apolar, apolar, polar.
d) polar, apolar, apolar.
e) apolar, apolar, apolar.
19) O aumento de diferença de eletronegatividade entre os elementos ocasiona a seguinte ordem no caráter das ligações
a) covalente polar, covalente apolar, iônica.
b) iônica, covalente polar, covalente apolar.
c) covalente apolar, iônica, covalente polar.
d) covalente apolar, covalente polar, iônica.
e) iônica, covalente apolar, covalente polar.
20) A ligação C - H é praticamente apolar devido a uma pequena diferença de eletronegatividade entre os átomos. Nessas condições, é apolar a molécula
a) 3HC-CH2-OH
b) 3HC-CH2-NH2
c) 3HC-CH2-Cl
d) 3HC-O-CH3
e) 3HC-CH3
5) D 6) B 7) B 8) A 9) D 10) A 11) A 12) E 13) D 14) B 15) B 16) E 17) E 18) A
19) D 20) E


- Dicas Para Os Vestibulandos
Química Geral, Físico-Química e Orgânica 1. O processo de separação de misturas denominado destilação fracionada separa os componentes da mistura pelos diferentes pontos de ebulição. 2. Alótropos são substâncias simples...
- Diferença Entre Dissociação Iônica E Ionização
Na água, os compostos iônicos sofrem dissociação, e os moleculares sofrem ionização Se colocarmos cloreto de sódio, o sal de cozinha (NaCl), em um recipiente contendo água, o que ocorrerá é que os íons já existentes no retículo cristalino...
- Simulado De Química
1-) NH 3 , H 2 O e CH 4 são, respectivamente, moléculas: a) polar, polar, apolar b) polar, polar, polar c) apolar, apolar, polar d) polar, apolar, apolar e) apolar, apolar, apolar 2-) (MED ? SANTOS) Nas dispersões coloidais, o diâmetro das partículas...
- Geometria Molecular Resumo(com Questões)
Geometria molecular A geometria molecular explica como estão dispostos os átomos dentro da molécula. Os átomos tendem a ficar numa posição mais espaçada, esparramada possível. Assim conseguem adquirir a estabilidade. As geometrias moleculares...
- Interações Intermoleculares Resumo (com Questões)
INTERAÇÕES INTERMOLECULARES As moléculas se atraem. Deste fato simples, surgem importantes conseqüências. Rios, lagos e oceanos existem porque as moléculas se atraem e formam um líquido. Sem esse líquido não haveria vida. Sem as forças entre...
